
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、25℃时,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸保存在无色玻璃瓶中 |
| B、少量金属钠可保存在煤油里 |
| C、新制氯水保存在棕色试剂瓶中 |
| D、少量液溴可加水水封,并放置于阴凉处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
| B、漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同 |
| C、将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 |
| D、向FeCl2溶液中通入Cl2反应的离子方程式为:Fe2++Cl2═Fe3++2C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据化学反应中的热效应将化学反应分为放热反应和吸热反应 |
| B、根据水溶液能否导电将化合物分为电解质和非电解质 |
| C、根据氧化物的组成将氧化物分为酸性氧化物、碱性氧化物和两性氧化物 |
| D、根据分散质和分散剂的聚集状态将分散系为浊液、胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
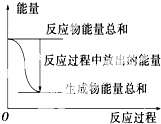
| A、反应过程中能量关系如上图表示,则该反应为放热反应 |
| B、若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C、化学反应的焓变与反应方程式的计量数有关 |
| D、若将该反应设计成原电池,锌为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度和压强下,各种气态物质的体积大小,由构成气体的分子大小决定的 |
| B、不同的气体,若体积不同,则他们的分子数也不同 |
| C、一定温度和压强下,各种气态物质的体积大小,由构成气体的分子数决定的 |
| D、气体摩尔体积是指1 mol任何气体所占的体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com