
 ,
,分析 A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大,D是地壳中含量最多的元素,所以D是氧元素;D与G同主族,所以G是硫元素;A分别与C、D可形成含有10个电子的共价化合物M、N,所以A为氢元素,C为氮元素,M为NH3,N为H2O;A与E主族,E、F、G、H同周期,所以E为钠元素,H为氯元素;B的最外层电子数是其电子层数的2倍,所以B为碳元素;F位于B的前一主族,结合原子序数可知F为铝元素.
解答 解:A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大,D是地壳中含量最多的元素,所以D是氧元素;D与G同主族,所以G是硫元素;A分别与C、D可形成含有10个电子的共价化合物M、N,所以A为氢元素,C为氮元素,M为NH3,N为H2O;A与E主族,E、F、G、H同周期,所以E为钠元素,H为氯元素;B的最外层电子数是其电子层数的2倍,所以B为碳元素;F位于B的前一主族,结合原子序数可知F为铝元素.
(1)B为碳元素,处于周期表中第2周期ⅣA族,M为NH3,为三角锥形结构,
故答案为:第2周期ⅣA族;三角锥形;
(2)A、D、E三种元素组成一种常见化合物为NaOH,该化合物的电子式为 ,工业上电解饱和食盐水生成氢氧化钠与氯气,该反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
,工业上电解饱和食盐水生成氢氧化钠与氯气,该反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为: ;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)E、F元素的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(4)发生反应:NH3+H3O+═NH4++H2O,说明NH3结合H+能力比H2O强,
故答案为:NH3;NH3+H3O+═NH4++H2O;
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,则X、Y分别为Na2O2和Na2S,其中Na2S的水溶液由于硫离子水解而使溶液显碱性,其离子方程式为S2-+H2O?HS-+OH-;
常温下7.8g Na2O2(即为0.1mol),与水反应放出Q kJ热量(Q>0),则2molNa2O2与水反应放出20Q kJ的热,所以该反应的热化学方程式为:2Na2O2(s)+2H2O(1)═4NaOH(aq)+O2(g)△H=-20Q kJ/mol,
故答案为:S2-+H2O?HS-+OH-;2Na2O2(s)+2H2O(1)═4NaOH(aq)+O2(g)△H=-20Q kJ/mol.
点评 本题考查元素化合物推断、元素化合物组成与性质、常用化学用语等,是对基础知识的综合运用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 8g O2 | B. | 0.3mol NaCl | ||
| C. | 标准状况下4.48L CH4 | D. | 含有3.01×1022个氧原子的H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 漂白粉的成分为次氯酸钙 | |
| D. | SO2可用于漂白食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
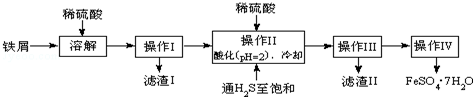
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于杀菌、消毒,但不可用来加工食品 | |
| B. | 液氨汽化时要吸收大量热,因此氨常用作制冷剂 | |
| C. | 二氧化硅与水不反应,说明二氧化硅不是酸性氧化物 | |
| D. | 铝箔在酒精灯上加热铝熔化但不滴落,说明氧化铝的熔点高于铝的熔点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com