
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
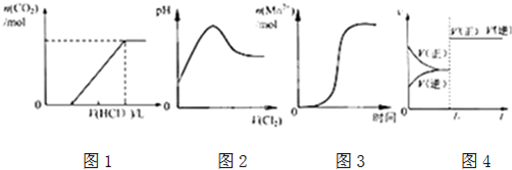
| A、图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol?L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
| B、图2表示Cl2通入H2S溶液中pH的变化 |
| C、图3表示10 mL 0.01 mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) |
| D、图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学键的断裂和形成是化学反应中能量变化的主要原因 |
| B、放热反应和吸热反应决定于反应物的总能量与生成物的总能量的相对大小 |
| C、化学反应中能量变化,通常主要表现为热量的变化------放热或者吸热 |
| D、凡经加热而发生的化学反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 |
| B、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D、SiO2 是酸性氧化物,能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白 红 白 |
| B、红 黑 红 |
| C、红 红 红 |
| D、白 黑 白 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com