
ЁОЬтФПЁПЯТЭМЪЧФГЭЌбЇЩшМЦЕФбщжЄдЕчГиКЭЕчНтГиЕФЪЕбщзАжУЃЌЯТСагаЙиЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
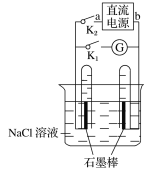
A. ЙиБеK2ЁЂДђПЊK1ЃЌЪдЙмФкСНМЋЖМгаЦјХнВњЩњ
B. ЙиБеK2ЁЂДђПЊK1ЃЌвЛЖЮЪБМфКѓЃЌЗЂЯжзѓВрЪдЙмЪеМЏЕНЕФЦјЬхБШгвВрТдЖрЃЌдђaЮЊИКМЋЃЌbЮЊе§МЋ
C. ЙиБеK2ЃЌДђПЊK1ЃЌвЛЖЮЪБМфКѓЃЌгУФДжИЖТзЁЪдЙмвЦГіЩеБЃЌЯђЪдЙмФкЕЮШыЗгЬЊЃЌЗЂЯжзѓВрЪдЙмФкШмвКБфКьЩЋЃЌдђaЮЊИКМЋЃЌbЮЊе§МЋ
D. ЙиБеK2ЃЌДђПЊK1ЃЌвЛЖЮЪБМфКѓЃЌдйЙиБеK1ЃЌДђПЊK2ЃЌМьСїМЦжИеыВЛЛсЦЋзЊ
ЁОД№АИЁПD
ЁОНтЮіЁП
A.ЙиБеK2ЃЌДђПЊK1ЃЌИУзАжУЮЊЕчНтГиЃЌNaClШмвКБЛЕчНтЃЌвѕМЋВњЩњЧтЦјЃЌбєМЋВњЩњТШЦјЃЛ
B.гЩгкТШЦјдкЫЎжаЕФШмНтЖШБШЧтЦјДѓЃЌвЛЖЮЪБМфКѓЃЌЪдЙмжаЬхЛ§ДѓЕФЦјЬхЮЊЧтЦјЃЛ
C.ВњЩњЧтЦјЕФвЛМЋЯћКФСЫЧтРызгЃЌШмвКЯдМюадЃЌМюадШмвКФмЪЙЗгЬЊШмвКБфКьЃЛ
D.вЛЖЮЪБМфКѓЃЌдйЙиБеK1ЃЌДђПЊK2ЪБЃЌЧтЦјЁЂТШЦјКЭNaClШмвКФмаЮГЩдЕчГиЁЃ
A.ЙиБеK2ЃЌДђПЊK1ЃЌИУзАжУЮЊЕчНтГиЃЌNaClШмвКБЛЕчНтЃЌСНМЋЗжБ№ВњЩњЧтЦјКЭТШЦјЃЌЙЪAе§ШЗЃЛ
B.гЩгкТШЦјдкЫЎжаЕФШмНтЖШБШЧтЦјДѓЃЌвЛЖЮЪБМфКѓЃЌЦјЬхЬхЛ§ДѓЕФЮЊЧтЦјЃЌИУЕчМЋЮЊвѕМЋЃЌгыИУМЋЯрСЌЕФЕчдДЕчМЋМДЮЊИКМЋЃЛдђЩњГЩТШЦјЕФЕчМЋЮЊбєМЋЃЌгыИУМЋЯрСЌЕФЕчдДЕчМЋМДЮЊе§МЋЃЌЙЪBе§ШЗЃЛ
C.ВњЩњЧтЦјЕФвЛМЋЯћКФСЫЫЎЕчРыЕФЧтРызгЃЌДйНјСЫЫЎЕФЕчРыЃЌШмвКЯдМюадЃЌМюадШмвКФмЪЙЗгЬЊШмвКБфКьЃЌЙЪCе§ШЗЃЛ
D.вЛЖЮЪБМфКѓЃЌдйЙиБеK1ЃЌДђПЊK2ЪБЃЌЧтЦјЁЂТШЦјКЭNaClШмвКФмаЮГЩдЕчГиЃЌЗХЕчЪБЛсв§Ц№ЕчСїМЦжИеыЗЂЩњЦЋвЦЃЌЙЪDДэЮѓЁЃ
ЙЪбЁDЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪТЪЕжаВЛФмгУРеЯФЬиСадРэНтЪЭЕФЪЧ
A.H2(g) + I2(g)![]() 2HI(g)ЦНКтКѓдіДѓбЙЧПбеЩЋБфЩю
2HI(g)ЦНКтКѓдіДѓбЙЧПбеЩЋБфЩю
B.Fe(SCN)3ШмвКжаМгШыЙЬЬхKSCNКѓбеЩЋБфЩю
C.N2 + 3H2![]() 2NH3 ІЄH<0 ЙЄвЕЩЯВЩгУИпЮТЬѕМўИќгаРћгкКЯГЩАБ
2NH3 ІЄH<0 ЙЄвЕЩЯВЩгУИпЮТЬѕМўИќгаРћгкКЯГЩАБ
D.ЯђAgClаќзЧвКжаМгШыKIШмвКЃЌгаЛЦЩЋГСЕэЩњГЩ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПCOЁЂH2ЪЧУКЕФЦјЛЏВњЮяЃЌдкЩњВњЩњЛюжагУЭОЙуЗКЁЃ
ЃЈ1ЃЉCOЛЙдЗЈДІРэДѓЦјЮлШОЮяSO2
Ђй2COЃЈgЃЉ + SO2ЃЈgЃЉ ![]() SЃЈsЃЉ+2CO2ЃЈgЃЉ H = -270 kJЁЄmolЃ1ЃЌИУЗДгІЕФЦНКтГЃЪ§БэДяЪНЮЊ__ЁЃ
SЃЈsЃЉ+2CO2ЃЈgЃЉ H = -270 kJЁЄmolЃ1ЃЌИУЗДгІЕФЦНКтГЃЪ§БэДяЪНЮЊ__ЁЃ
ЂкдкОјШШКуШнЕФУмБеШнЦїжаНјааЩЯЪіЗДгІЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ_____ЁЃ
a ШєЛьКЯЦјЬхУмЖШБЃГжВЛБфЃЌдђвбДяЦНКтзДЬЌ
b ДяЦНКтКѓШєдйГфШЫвЛЖЈСПCO2ЃЌЦНКтГЃЪ§БЃГжВЛБф
c ЗжРыГіВПЗжSЃЌе§ЁЂФцЗДгІЫйТЪОљБЃГжВЛБфЃЌЦНКтВЛвЦЖЏ
d ДгЗДгІПЊЪМЕНЦНКтЃЌШнЦїФкЦјЬхЕФбЙЧПБЃГжВЛБф
ЂлЯђ2 LКуЮТКуШнУмБеШнЦїжаЭЈШЫ2 mol COЁЂ1 mol SO2ЃЌЗжБ№НјааaЁЂbЁЂcШ§зщЪЕбщЁЃдкВЛЭЌДпЛЏМСМўЯТЗЂЩњЗДгІЃК2COЃЈgЃЉ + SO2ЃЈgЃЉ ![]() SЃЈsЃЉ+2CO2ЃЈgЃЉ H = -270 kJЁЄmolЃ1ЃЌЗДгІЬхЯЕзмбЙЫцЪБМфЕФБфЛЏШчЯТБэЫљЪОЃЌдђШ§зщЪЕбщЮТЖШЕФДѓаЁЙиЯЕЪЧ_____ЃЈгУaЁЂbЁЂcБэЪОЃЉЃЌЪЕбщaДгЗДгІПЊЪМжС45sДяЕНЦНКтЃЌдђИУЙ§ГЬЗДгІЫйТЪvЃЈSO2ЃЉ__________ЃЈНсЙћБЃСє2ЮЛгааЇЪ§зжЃЉЁЃ
SЃЈsЃЉ+2CO2ЃЈgЃЉ H = -270 kJЁЄmolЃ1ЃЌЗДгІЬхЯЕзмбЙЫцЪБМфЕФБфЛЏШчЯТБэЫљЪОЃЌдђШ§зщЪЕбщЮТЖШЕФДѓаЁЙиЯЕЪЧ_____ЃЈгУaЁЂbЁЂcБэЪОЃЉЃЌЪЕбщaДгЗДгІПЊЪМжС45sДяЕНЦНКтЃЌдђИУЙ§ГЬЗДгІЫйТЪvЃЈSO2ЃЉ__________ЃЈНсЙћБЃСє2ЮЛгааЇЪ§зжЃЉЁЃ
| 0s | 40s | 45s | 60s |
a | 175 | 142 | 140 | 140 |
b | 160 | 120 | 120 | 120 |
c | 160 | 130 | 125 | 120 |
ЃЈ2ЃЉРћгУCOЁЂH2ПЩжЦБИЬьШЛЦјЃЌжївЊЗДгІЮЊЃК
COЃЈgЃЉ + 3H2ЃЈgЃЉ ![]() CH4ЃЈgЃЉ + H2OЃЈgЃЉ H1=-206.2 kJЁЄmol1ЃЛ
CH4ЃЈgЃЉ + H2OЃЈgЃЉ H1=-206.2 kJЁЄmol1ЃЛ
COЃЈgЃЉ + H2OЃЈgЃЉ ![]() CO2ЃЈgЃЉ + H2ЃЈgЃЉ H2 = -41.0 kJЁЄmolЃ1ЃЛ
CO2ЃЈgЃЉ + H2ЃЈgЃЉ H2 = -41.0 kJЁЄmolЃ1ЃЛ
H2OЃЈlЃЉ ЈTH2OЃЈgЃЉ H3 =+44 kJЁЄmolЃ1 ЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЂйЗДгІCO2ЃЈgЃЉ + 4H2ЃЈgЃЉ ![]() CH4ЃЈgЃЉ + 2H2OЃЈlЃЉ ЕФH4 = ________ kJЁЄmolЃ1ЁЃФГЮТЖШЯТЃЌЗжБ№дкЦ№ЪМШнЛ§ЯрЭЌЕФКубЙШнЦїAЁЂКуШнШнЦїBжаМгШЫ1molCO2КЭ4molH2ЕФЛьКЯЦјЬхЃЌСНШнЦїЗДгІДяЕНЦНКтКѓЗХГіЛђЮќЪеЕФШШСПНЯЖрЕФЪЧ__ЃЈ ЬюЁАAЁБЛђЁАB"ЃЉЁЃ
CH4ЃЈgЃЉ + 2H2OЃЈlЃЉ ЕФH4 = ________ kJЁЄmolЃ1ЁЃФГЮТЖШЯТЃЌЗжБ№дкЦ№ЪМШнЛ§ЯрЭЌЕФКубЙШнЦїAЁЂКуШнШнЦїBжаМгШЫ1molCO2КЭ4molH2ЕФЛьКЯЦјЬхЃЌСНШнЦїЗДгІДяЕНЦНКтКѓЗХГіЛђЮќЪеЕФШШСПНЯЖрЕФЪЧ__ЃЈ ЬюЁАAЁБЛђЁАB"ЃЉЁЃ
ЂкдкКубЙЙмЕРЗДгІЦїжаАДnЃЈH2ЃЉ:nЃЈCOЃЉ = 3:1ЭЈШыдСЯЦјЃЌдкДпЛЏМСзїгУЯТжЦБИКЯГЩЬьШЛЦјЃЌ400 Ёц pзмЮЊ100 kPaЪБЗДгІЬхЯЕЦНКтзщГЩШчЯТБэЫљЪОЃК
зщЗж | CH4 | H2O | H2 | CO2 | CO |
ЬхЛ§ЗжЪ§/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
дђИУЬѕМўЯТCOЕФзмзЊЛЏТЪІС=____ЁЃ![]()
ЂлжЦБИКЯГЩЬьШЛЦјВЩгУдкдСЯЦјжаЭЈШыЫЎеєЦјРДЛКНтДпЛЏМСЛ§ЬМЁЃ
Л§ЬМЗДгІЮЊЃКЗДгІI ЃКCH4ЃЈgЃЉ ![]() CЃЈsЃЉ + 2H2ЃЈgЃЉ H = +75 kJЁЄmolЃ1ЃЛ
CЃЈsЃЉ + 2H2ЃЈgЃЉ H = +75 kJЁЄmolЃ1ЃЛ
ЗДгІЂђЃК2COЃЈgЃЉ ![]() CЃЈsЃЉ + CO2ЃЈgЃЉ H = -172 kJЁЄmolЃ1ЃЌ
CЃЈsЃЉ + CO2ЃЈgЃЉ H = -172 kJЁЄmolЃ1ЃЌ
ЦНКтЬхЯЕжаЫЎеєЦјХЈЖШЖдЛ§ЬМСПЕФгАЯьШчЭМЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ__ЁЃ
A ЧњЯп1дк700 ~ 800ЁцЛ§ЬМСПМѕаЁЕФдвђПЩФмЪЧЗДгІЂђФцЯђвЦЖЏ
B ЧњЯп1дк550 ~700ЁцЛ§ЬМСПдіДѓЕФдвђПЩФмЪЧЗДгІIЁЂЂђЕФЫйТЪдіДѓ
C ЧњЯп2ЁЂ3дк550 ~800ЁцЛ§ЬМСПНЯЕЭЕФдвђЪЧЫЎеєЦјЯЁЪЭзїгУЪЙЛ§ЬМЗДгІЫйТЪМѕаЁ
D ЫЎеєЦјФмЮќЪеЗДгІЗХГіЕФШШСПЃЌНЕЕЭЬхЯЕЮТЖШжС550ЁцвдЯТЃЌгаРћгкМѕЩйЛ§ЬМ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏКЯЮяHЪЧC5aЪмЬхозПЙМСW-54011ЕФжаМфЬхЃЌNakamuraЕШШЫЩшМЦжЦБИHЕФКЯГЩТЗЯпШчЭМЫљЪОЃК
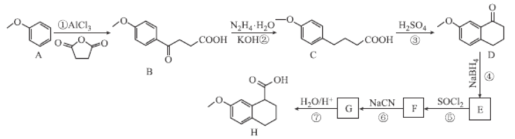
вбжЊЃКЂё. ЃЛ
ЃЛ
Ђђ.R-CN![]() R-COOHЁЃ
R-COOHЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉBжаКЌбѕЙйФмЭХЕФУћГЦЮЊ___ЁЃ
ЃЈ2ЃЉFЕФЗжзгЪНЮЊC13H13OClЃЌдђFЕФНсЙЙМђЪНЮЊ___ЁЃ
ЃЈ3ЃЉЂкЂнЕФЗДгІРраЭЗжБ№ЮЊ___ЁЂ___ЁЃ
ЃЈ4ЃЉЗДгІЂйЕФЛЏбЇЗНГЬЪНЮЊ___ЁЃ
ЃЈ5ЃЉЬМдзгЩЯСЌга4ИіВЛЭЌЕФдзгЛђЛљЭХЪБЃЌИУЬМГЦЮЊЪжадЬМЃЌаДГіЛЏКЯЮяHгызуСПH2ЗЂЩњМгГЩЗДгІЕФВњЮяЕФНсЙЙМђЪН___ЃЌВЂгУаЧКХ(*)БъГіЦфжаЕФЪжадЬМЃК
ЃЈ6ЃЉQгыCЛЅЮЊЭЌЗжвьЙЙЬхЃЌQгіFeCl3ШмвКЗЂЩњЯдЩЋЗДгІЃЌЧвБНЛЗЩЯСЌгаСНИіШЁДњЛљЃЌ1molQгызуСПNaHCO3ШмвКЗДгІзюЖрВњЩњ1molCO2ЃЌдђQЕФЭЌЗжвьЙЙЬхга___жжЃЈВЛКЌСЂЬхвьЙЙЃЉЦфжаКЫДХЙВеёЧтЦзга6зщЮќЪеЗхЕФНсЙЙМђЪНЮЊ___(ШЮаДвЛжж)ЁЃ
ЃЈ7ЃЉВЮееЩЯЪіКЯГЩТЗЯпКЭаХЯЂЃЌЩшМЦвдБНввШЉЮЊдСЯ(ЦфЫќЪдМСШЮбЁ)ЃЌжЦБИ![]() ЕФКЯГЩТЗЯпЃК___ЁЃ
ЕФКЯГЩТЗЯпЃК___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЪЕбщЗНЗЈКЭНсТлЖМе§ШЗЕФЪЧ
A.ЫсМюжаКЭЕЮЖЈЪБЃЌзЖаЮЦПашгУД§ВтвКШѓЯД2ДЮЃЌдйМгШыД§ВтвК
B.МьбщесЬЧЫЎНтВњЮяОпгаЛЙдадЃКдкесЬЧЫЎНтКѓЕФШмвКжаЯШМгШыЪЪСПЯЁNaOHШмвКжаКЭЃЌдйМгШыаТжЦЕФвјАБШмвКВЂЫЎдЁМгШШ
C.ЭМжаЫсЪНЕЮЖЈЙмЖСЪ§ЮЊ12.20 mL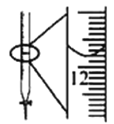
D.ШєгУвбжЊХЈЖШЕФKMnO4ШмвКШЅВтЖЈФГШмвКжаFe2+ХЈЖШЃЌKMnO4ШмвКЗХдкМюЪНЕЮЖЈЙмжа
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌНјааЯТЭМЫљЪОЕЮЖЈВЂЕУЕНЖдгІЧњЯпЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ( )

A.Ka2(H2C2O4)=10-4.19
B.жБЯпЂёжаX=![]()
C.дкNaHC2O4ШмвКжаc(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
D.ЂёЁЂЂђСНЬѕжБЯпЕФаБТЪОљЮЊ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНќФъРДЃЌЙквдЁАТЬЩЋЁБЕФаТИХФюВЛЖЯВњЩњЃЌШчТЬЩЋЪГЦЗЁЂТЬЩЋВФСЯЁЂТЬЩЋФмдДЁЂТЬЩЋЛЏбЇЕШЃЌетРяЕФЁАТЬЩЋЁБЪЧЖдШЫРрЩчЛсПЩГжајЗЂеЙеНТдЕФаЮЯѓБэЪіЁЃЁАТЬЩЋЛЏбЇЁБвЊЧѓДгОМУЁЂЛЗБЃКЭММЪѕЩЯЩшМЦПЩааЕФЛЏбЇЗДгІЁЃОнДЫЃЌгЩЕЅжЪУОжЦЯѕЫсУОЕФЯТСа4ИіЗНАИжаЃЌФуШЯЮЊПЩааЖјЧвЗћКЯЁАТЬЩЋЛЏбЇЁБвЊЧѓЕФЗНАИЪЧЃЈ ЃЉ
A.![]()
B.![]()
C.Mg![]() MgO
MgO![]() Mg(NO3)2
Mg(NO3)2
D.![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЮТЖШЯТЃЌЯђвЛИіШнЛ§ПЩБфЕФШнЦїжаЃЌЭЈШы3 mol SO2КЭ2 mol O2МАЙЬЬхДпЛЏМСЃЌЪЙжЎЗЂЩњЗДгІЃК2SO2(g)+O2(g) ![]() 2SO3(g)ЁЁІЄH=ЁЊ196.6 kJЁЄmol-1ЃЌвЛЖЮЪБМфКѓДяЕНЦНКтЃЌЦНКтЪБШнЦїФкЦјЬхзмЕФЮяжЪЕФСПЮЊЦ№ЪМЪБЕФ90%ЃЎЯТСаЫЕЗЈе§ШЗЕФЪЧ ЃЈ ЃЉ
2SO3(g)ЁЁІЄH=ЁЊ196.6 kJЁЄmol-1ЃЌвЛЖЮЪБМфКѓДяЕНЦНКтЃЌЦНКтЪБШнЦїФкЦјЬхзмЕФЮяжЪЕФСПЮЊЦ№ЪМЪБЕФ90%ЃЎЯТСаЫЕЗЈе§ШЗЕФЪЧ ЃЈ ЃЉ
A.ДяЕНЦНКтЪБSO2ЕФзЊЛЏТЪдМЮЊ33.3%
B.ДяЕНЦНКтЪБЗДгІЗХГіЕФШШСПЮЊ294.9 kJ
C.ЦНКтЪБSO3ЕФЮяжЪЕФСПЮЊ2mol
D.ДяЦНКтЪБгУO2БэЪОЕФЗДгІЫйТЪЮЊ0.25 molЁЄL-1ЁЄmin-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1) AЁЂBЁЂCШ§ИіЩеБжаЗжБ№ЪЂгаЯрЭЌЮяжЪЕФСПХЈЖШЕФЯЁСђЫсЁЃ
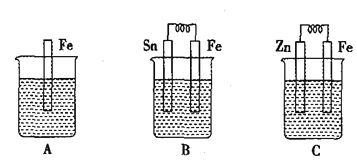
ЂйBжаSnМЋЕФЕчМЋЗДгІЪНЮЊ__________ЃЌSnМЋИННќШмвКЕФpH_____ЃЈЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉЁЃ
ЂкCжазмЗДгІРызгЗНГЬЪНЮЊ_____________ЃЌБШНЯAЁЂBЁЂCжаЬњБЛИЏЪДЕФЫйТЪЃЌгЩПьЕНТ§ЕФЫГађЪЧ________ЁЃ
(2ЃЉШчЭМЪЧМзЭщШМСЯЕчГидРэЪОвтЭМЃЌЛиД№ЯТСаЮЪЬтЃК

ЂйЕчГиЕФИКМЋЪЧ______ЃЈЬюЁАaЁБЛђЁАbЁБЃЉЕчМЋЃЌИУМЋЕФЕчМЋЗДгІЪЧ_______ЁЃ
ЂкЕчГиЙЄзївЛЖЮЪБМфКѓЕчНтжЪШмвКЕФpH____ЃЈЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com