
【题目】Ⅰ.下列各组粒子,属于同种核素的是___________(填编号,下同),互为同位素的是___________,互为同素异形体的是___________,互为同分异构体的是___________,属于同种物质的是_____________,互为同系物的是__________。
①16O2和18O3 ② CH4 和C3H8 ③ H、D、T④ 3015R和 (核内15个中子)⑤CH3CH2OH和CH3OCH3⑥
(核内15个中子)⑤CH3CH2OH和CH3OCH3⑥ 和
和
Ⅱ.能源是现代社会发展的支柱之一。
⑴化学反应中的能量变化,主要表现为热量的变化。
①下列反应中,属于放热反应的是_________(填字母)。
A.Ba(OH)2·8H2O与NH4Cl混合搅拌 B.高温煅烧石灰石
C.铝与盐酸反应 D.C+H2O(g)=CO+ H2
②拆开1mol H﹣H键,1mol N﹣H键,1mol N≡N键分别需要吸收的能量
为a kJ,b kJ,c kJ,则1molN2和H2完全反应生成2mol NH3需要放出的热量为____________kJ。
⑵电能是现代社会应用最广泛的能源之一。

如下图所示的原电池装置中,负极是_______,正极上能够观察到的现象是_______________________,正极的电极反应式是_____________________。原电池工作一段时间后,若消耗锌6.5 g,则放出气体________g。
【答案】④ ③ ① ⑤ ⑥ ② C (6b﹣3a﹣c) Zn 铜片表面产生无色气泡 2H++2e-=H2↑ 0.2
【解析】
Ⅰ.核素是指具有一定数目质子和一定数目中子的一种原子;具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;具有相同分子式而结构不同的化合物互为同分异构体;同素异形体是同种元素形成的不同单质;分子式相同、结构也相同的物质属于同种物质;结构相似、分子组成相差若干个CH2原子团的有机物互为同系物;
Ⅱ.⑴常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;
②成键放出的总能量-断键吸收的总能量=反应放出的能量;
⑵原电池中,活泼电极为负极;正极上氢离子得电子生成氢气;负极是锌失电子生成锌离子;根据原电池总反应方程式计算生成氢气的质量。
Ⅰ.①16O2和18O3 是同种元素形成的不同单质,互为同素异形体;②CH4 和C3H8结构相似、分子组成相差2个CH2原子团,属于同系物;③![]() 是具有相同质子数、不同中子数的同一元素的不同原子,互为同位素;④
是具有相同质子数、不同中子数的同一元素的不同原子,互为同位素;④![]() 和
和 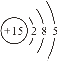 (核内15个中子)质子数和中子数都相同,属于同种核素;⑤CH3CH2OH和CH3OCH3是具有相同分子式,结构不同的化合物,互为同分异构体;⑥
(核内15个中子)质子数和中子数都相同,属于同种核素;⑤CH3CH2OH和CH3OCH3是具有相同分子式,结构不同的化合物,互为同分异构体;⑥ 分子式相同,结构相同,属于同种物质。故属于同种核素的是④,互为同位素的是③,互为同素异形体的是①,互为同分异构体的是⑤,属于同种物质的是⑥,互为同系物的是②。
分子式相同,结构相同,属于同种物质。故属于同种核素的是④,互为同位素的是③,互为同素异形体的是①,互为同分异构体的是⑤,属于同种物质的是⑥,互为同系物的是②。
Ⅱ.⑴A.Ba(OH)28H2O与NH4Cl混合搅拌是吸热反应,故不选A;
B.高温煅烧石灰石是吸热反应,故不选B;
C.铝与盐酸反应是放热反应,故选C;
D、C或氢气做还原剂时的反应是吸热反应,C+H2O(g)=CO+ H2是吸热反应,故不选D。
②![]()
![]()
![]() 生成2mol NH3吸收热量1mol×ckJ/mol+akJ/mol×3mol,放出热量bkJ/mol×3×2mol,放出6b﹣(3a+c)kJ=(6b﹣3a﹣c) kJ。
生成2mol NH3吸收热量1mol×ckJ/mol+akJ/mol×3mol,放出热量bkJ/mol×3×2mol,放出6b﹣(3a+c)kJ=(6b﹣3a﹣c) kJ。
⑵原电池中,活泼电极为负极,锌的活泼性大于铜,所以负极是Zn;正极上氢离子得电子生成氢气,正极反应式是2H++2e-=H2↑,现象是铜片表面产生无色气泡;负极是锌失电子生成锌离子;
原电池总反应为Zn+2H+= Zn2++H2↑,设生成氢气的质量为xg。
Zn+2H+= Zn2++H2↑
65 2
6.5 xg
![]()
X=0.2g。


科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A. 从1L 1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1
B. 制成0.5L 10mol·L-1的盐酸,需要氯化氢气体112L(标准状况)
C. 0.5L 2mol·L-1 BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D. 10g 98%硫酸(密度为1.84g·cm-3)与10mL 18.4mol·L-1硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Fe2+的核外电子排布式为_________________________________。
(2)元素的第三电离能I3:Fe______Mn(填“>”或:“<”)。
(3)H2O的沸点比H2S高的原因是_______________________________________。
(4)亚西尔阿拉法特的死因被怀疑是钋—210中毒。钋与氧同族,基态钋原子有________个未成对电子。钋沉积在铍(9Be)上用作原子弹的中子源。铍的氯化物BeCl2室温下为雪白色易升华的固体,能溶于水和部分有机溶剂。室温下BeCl2固体属于__________晶体,500-600°C时,氯化铍以二聚体的形式存在,其二聚体的结构式为__________________(配位键用“→”表示)。
(5)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
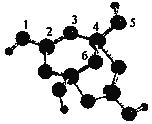
①在Xm-中,数字标号为4的硼原子的轨道杂化类型为___________;m=_______填数字)。
②若硼砂的式量为382 , 则其化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素A~E在元素周期表中的相对位置如表所示,下面判断正确的是( )

A. 氢氧化物的化学式及其碱性:COH>D(OH)2>E(OH)3
B. 金属性:A>C
C. 原子半径:C<D<E
D. 最外层电子数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4g)(无色),如图所示.
N2O4g)(无色),如图所示.
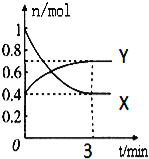
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若降低温度,则v(正) ,v(逆) .(填“加快”或“减慢”或“不变”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol/(Ls),乙中v(N2O4)=6mol/(Lmin),则 中反应更快.
(4)在0到3min中内N2O4的反应速率为 .
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A.v(NO2)=2v(N2O4) |
B.容器内压强不再发生变化 |
C.X的体积分数不再发生变化 |
D.容器内气体原子总数不再发生变化 |
E.相同时间内消耗n mol的Y的同时生成2n mol的X
F.相同时间内消耗n mol的Y的同时消耗2n mol的X.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下刎有关实验装置、操作,不能实现相应实验目的的是

A. 装置甲可用酸性KMnO4溶液滴定FeSO4溶液
B. 用装置乙进行实验时若逐滴滴加AgNO3溶液先出现黄色沉淀,可说明 Ksp(AgCl)>Ksp(AgI)
C. 装置丙可用于收集氢气
D. 装置丁可用于 NaOH溶液除去溴苯中单质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下的可逆反应:A(s)+2B(g) ![]() 2C(g)+D(g) △H<0,在甲容器充入2molA、2molB并保持压强不变,乙容器充入2molC、 1mol D并保持体积不变,起始时甲、乙两容器气体体积相等。为使平衡时两容器中B的浓度相等,下列措施不可行的是
2C(g)+D(g) △H<0,在甲容器充入2molA、2molB并保持压强不变,乙容器充入2molC、 1mol D并保持体积不变,起始时甲、乙两容器气体体积相等。为使平衡时两容器中B的浓度相等,下列措施不可行的是
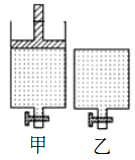
A. 乙容器中分离出一定量的D气体
B. 向甲谷器中再充入一定量的B气体
C. 将甲的活塞往下压至反应前的位置
D. 适当降低乙容器的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PSCl3 、S2Cl2、SOCl2等含硫化合物用途非常广泛。
(1)PSCl3(结构式为: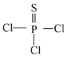 )中磷的化合价为______。
)中磷的化合价为______。
(2)S2Cl2分子中各原子均满足8电子结构,画出S2Cl2的结构式:_____。
(3)能说明同周期的相邻元素S的非金属性比Cl弱的事实是_____(填标号)。
A.H2SO3的酸性比HClO3的弱
B.气态H2S的热稳定性比HCl的弱
C.Cl2通入Na2S溶液可发生反应:Cl2+S2-=2Cl-+S↓
D.SO2是常见的还原剂,ClO2是常见的氧化剂
(4)SOCl2(沸点78.8℃)可用作锂电池的非水电解质及有机合成的氯化剂等。
①SOCl2可由S2Cl2、SO2及Cl2在催化剂和180~200℃时,通过发生化合反应制得,该反应的化学方程式为_____。
②Li/SOCl2电池的电池反应为:4Li+2SOCl2→4LiCl↓+S+SO2。电池工作时,下列说法正确的是____(填标号)。
A.Li电极的质量不变 B.电能转变为化学能
C.负极发生氧化反应 D.正极上SOCl2被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com