
【题目】(1)基态Fe2+的核外电子排布式为_________________________________。
(2)元素的第三电离能I3:Fe______Mn(填“>”或:“<”)。
(3)H2O的沸点比H2S高的原因是_______________________________________。
(4)亚西尔阿拉法特的死因被怀疑是钋—210中毒。钋与氧同族,基态钋原子有________个未成对电子。钋沉积在铍(9Be)上用作原子弹的中子源。铍的氯化物BeCl2室温下为雪白色易升华的固体,能溶于水和部分有机溶剂。室温下BeCl2固体属于__________晶体,500-600°C时,氯化铍以二聚体的形式存在,其二聚体的结构式为__________________(配位键用“→”表示)。
(5)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
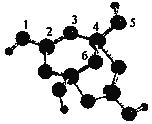
①在Xm-中,数字标号为4的硼原子的轨道杂化类型为___________;m=_______填数字)。
②若硼砂的式量为382 , 则其化学式为______________。
【答案】1s22s22p63s23p63d6 <水分子之间能形成氢键而H2S分子之间不能形成氢键2分子晶体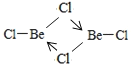 sp32Na2B4O5(OH)4 ·8H2O或Na2B4O7 ·10H2O或Na2 H4B4O9·8H2O
sp32Na2B4O5(OH)4 ·8H2O或Na2B4O7 ·10H2O或Na2 H4B4O9·8H2O
【解析】
根据核外电子排布规律书写;原子轨道处于半满、全满、全空时能量更低稳定;H2O分子间可以形成氢键;钋原子的外围电子排布式是6s26p4;易升华,溶于有机溶剂,说明该化合物形成的晶体是分子晶体;Be原子具有空轨道,氯原子具有孤对电子,可以形成配位键;依据价层电子对数判断杂化轨道类型;依据化合价代数和为零计算化学式;依据(H4B4O9)m-为(H4B4O9)2-、四硼酸钠的化学式为Na2B4O7和式量推断。
(1)铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成
Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6。(2)Mn元素为25号元素,核外电子排布式为[Ar]3d54s2,所以价层电子排布式为
3d54s2,由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的
3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5
半充满状态,需要的能量相对要少。(3)H2O与H2S都属于分子晶体,H2O分子间可以形成氢键,H2S只含有范德华力,所以水的沸点高于H2S的沸点。(4)钋原子的外围电子排布式是6s26p4,所以钋原子有2个未成对电子;BeCl2易升华,溶于有机溶剂,说明该化合物形成的晶体是分子晶体;BeCl2结构为Cl-Be-Cl,二聚体为氯原子的孤电子对提供给铍,所以(BeCl2)2结构简图为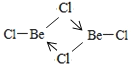 。(5)4号B形成4个键,价层电子对数为4,则B原子为SP3杂化;H可以形成1个共价键,O可以形成2个共价键,B可以形成3个共价键,所以最小的球为氢原子,共4个,颜色浅的大球为氧原子,共9个,颜色深的大球为硼原子,共4个,其化学式为(H4B4O9)m-,H为+1价,B为+3价,O为-2价,所以4×1+4×3-2×9=-m,得m=2;(H4B4O9)m-为(H4B4O9)2-,四硼酸钠的化学式为Na2B4O7,结合硼砂的式量为382可得四硼酸钠含有10个结晶水,则硼砂的化学式为Na2B4O7 ·10H2O。
。(5)4号B形成4个键,价层电子对数为4,则B原子为SP3杂化;H可以形成1个共价键,O可以形成2个共价键,B可以形成3个共价键,所以最小的球为氢原子,共4个,颜色浅的大球为氧原子,共9个,颜色深的大球为硼原子,共4个,其化学式为(H4B4O9)m-,H为+1价,B为+3价,O为-2价,所以4×1+4×3-2×9=-m,得m=2;(H4B4O9)m-为(H4B4O9)2-,四硼酸钠的化学式为Na2B4O7,结合硼砂的式量为382可得四硼酸钠含有10个结晶水,则硼砂的化学式为Na2B4O7 ·10H2O。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】关于煤、石油、天然气等资源的说法正确的是 ( )
A.石油裂解得到的汽油是纯净物
B.石油、煤、可燃冰、植物油都属于化石燃料
C.天然气是一种清洁的化工原料
D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c molL-1,密度为ρ gcm-3,则下列说法正确的是
A. 溶液密度ρ可表示为cMr/1000w
B. 物质的量浓度c可表示为ρV/(MrV+22.4m)
C. 溶液的质量分数w%可表示为:MrV/22.4m
D. 相对分子质量Mr可表示为:(22.4m×w%)/((1-w%)V)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将下列现象中硫酸表现出来的性质填写在空格内:敞口放置的浓硫酸,溶液质量增加_________________;浓硫酸与蔗糖放出大量热,并出现黑色固体____________;
(2)将一瓶二氧化硫和一瓶硫化氢气体瓶口对接进行混合,瓶壁上能观察到有_________________和_________________生成,其化学反应方程式为:____________________________ , 此反应中SO2作____________剂, 1 mol 二氧化硫和硫化氢完全反应时,有_________mol电子发生转移。
(3)当雨水的pH________时,我们称之为“酸雨”。某环保小组测定某次雨水中硫酸的物质的量浓度为5×10-6 mol/L,这次雨__________酸雨(选填“属于”或“不属于”)。常温下若把0.1mol/L的盐酸溶液稀释100倍,此时的溶液的pH=__________。
(4)将一充满氨气的大试管倒立在水槽中,可以看到现象_________________,说明_______________,若在此溶液中滴入酚酞试液,溶液呈_______色,其电离方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在强酸性溶液中大量共存的是
A. Na+、K+、SO42-、OH- B. Na+、K+、Cl-、HCO3-
C. Na+、Cu2+、CO32-、Br- D. Na+、Mg2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化学的认识中,正确的是()
A. CH3CH=CHCH3分子中的四个碳原子可能在同一直线上
B. 淀粉和纤维素属于多糖, 均可在在人体内水解转化为葡萄糖,为人类提供能量
C. 分子式为 C4H8O且能和金属钠反应的有机物共有三种(不考虑立体异构)
D. 分枝酸结构简式如图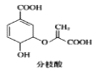 ,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.液态HCl不导电,所以HCl是非电解质
B.CO2的水溶液导电,所以CO2是电解质
C.铜、石墨均导电,所以它们都是电解质
D.蔗糖在水溶液中和熔融时均不导电,所以蔗糖是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列各组粒子,属于同种核素的是___________(填编号,下同),互为同位素的是___________,互为同素异形体的是___________,互为同分异构体的是___________,属于同种物质的是_____________,互为同系物的是__________。
①16O2和18O3 ② CH4 和C3H8 ③ H、D、T④ 3015R和 (核内15个中子)⑤CH3CH2OH和CH3OCH3⑥
(核内15个中子)⑤CH3CH2OH和CH3OCH3⑥ 和
和
Ⅱ.能源是现代社会发展的支柱之一。
⑴化学反应中的能量变化,主要表现为热量的变化。
①下列反应中,属于放热反应的是_________(填字母)。
A.Ba(OH)2·8H2O与NH4Cl混合搅拌 B.高温煅烧石灰石
C.铝与盐酸反应 D.C+H2O(g)=CO+ H2
②拆开1mol H﹣H键,1mol N﹣H键,1mol N≡N键分别需要吸收的能量
为a kJ,b kJ,c kJ,则1molN2和H2完全反应生成2mol NH3需要放出的热量为____________kJ。
⑵电能是现代社会应用最广泛的能源之一。

如下图所示的原电池装置中,负极是_______,正极上能够观察到的现象是_______________________,正极的电极反应式是_____________________。原电池工作一段时间后,若消耗锌6.5 g,则放出气体________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气、水体污染的治理是化学工作者研究的重要课题,燃煤的烟道气和汽车尾气是造成雾霾天气污染的原因之一。
(1)用CH4催化还原氮氧化物,已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1= a kJ/mol,欲计算反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(1)的焓变△H2,则还需要查找某化合反应的焓变△H3,该化合反应中各物质化学计量数之比为最简整数比时△H3=bkJ/mol,则该化合反应的热化学方程式为____________________。据此计算出△H2=__________kJ/mol(用含a和b的式子表示)。
(2)汽车尾气转化的反应之一:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H=-746.5kJ/mol。在某温度时,可按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表:
N2(g)+2CO2(g) △H=-746.5kJ/mol。在某温度时,可按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率υ(N2)=______________________________。
②在该温度下,反应的平衡常数K=___________(只写出计算结果)。
③对于该可逆反应,通过综合分析以上信息,至少可以说明___________(填字母)。
A.该反应的反应物混合后很不稳定
B.在催化剂的作用下,该反应一旦发生将在较短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)通过调节溶液pH,在弱碱性条件下,用漂白粉溶液可将废水中的CN-转化为碳酸盐和N2而除去。写出该反应的离子方程式为______________________。
(4)废水中的重金属离子通常用沉淀法除去。已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,国家规定的排放标淮:镍低于1.1×10-5mol·L-1,铜低于7.8×10-5mol·L-l。则需要控制溶液中S2-的浓度不低于__mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com