
| A.SO2、SO3 | B.NO 、O2 | C.HCl 、CS2 | D.CO2、SiO2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
| 元素 | A | B | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物的水溶液显碱性 | 原子有三个电子层,简单离子在本周期中半径最小 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaH中存在-1价的氢离子,还原性比氢原子强 |
| B.NaH与H2O反应时水作氧化剂,反应放出热量 |
| C.NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同 |
| D.微粒半径:H+>H>H- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有① | B.只有①② | C.只有②③ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
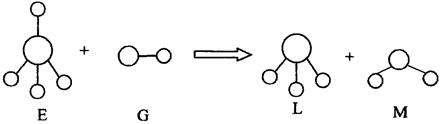
A.E、G、L、M都是10e 微粒 微粒 | B.L、M都是极性分子 |
| C.L能使紫色石蕊试液变蓝色 | D.E离子中,质子数一定大于中子数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 表。
表。| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数。 |
| Y | 原子核外的L层有3个未成对电子。 |
| Z | 在元素周期表的各元素中电负性仅小于氟。 |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
 共有 种不同运动状态的电子,有 种不同能级的电子。
共有 种不同运动状态的电子,有 种不同能级的电子。 物中,沸点由高到低
物中,沸点由高到低 的排列次序依次为(写化学式) 。
的排列次序依次为(写化学式) 。 l3 B.[R(H2O)5Cl]Cl2·H2O
l3 B.[R(H2O)5Cl]Cl2·H2O [R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O 污染环境,其反应的化学方程式为 。
污染环境,其反应的化学方程式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.固体的热稳定性:Na2CO3>CaCO3>NaHCO3 |
| B.微粒半径:Fe(OH)3胶粒>K+>C1->Na+ |
| C.电离出氢离子的能力:CH3COOH>C2H5OH>H2O |
| D.氢化物的沸点:H2Se>H2S>H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com