
| A. | C(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 室温下,PH=2的溶液中:Fe2+、SO42-、Na+、NO3- | |
| C. | 无色透明的溶液中:NH4+、Cl-、NO3-、Fe3+ | |
| D. | 使红色石蕊试纸变蓝的溶液中:SO32-、Na+、CO32-、K+ |
分析 A.碳酸氢根离子与铝离子发生双水解反应;
B.该溶液呈酸性,硝酸根离子在酸性条件下能够氧化亚铁离子;
C.铁离子为有色离子,不满足溶液无色的条件;
D.使红色石蕊试纸变蓝的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.HCO3-、Al3+之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,在溶液中不能大量共存,故A错误;
B.常温下pH=2的溶液呈酸性,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.Fe3+为有色离子,在溶液中不能大量存在,故C错误;
D.使红色石蕊试纸变蓝的溶液呈碱性,溶液中存在大量氢氧根离子,SO32-、Na+、CO32-、K+之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题
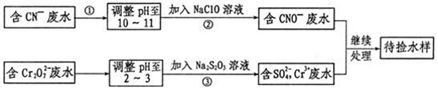
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
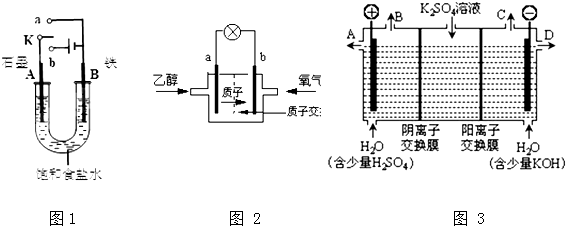
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
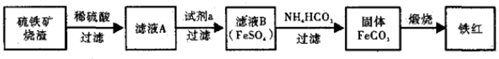
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
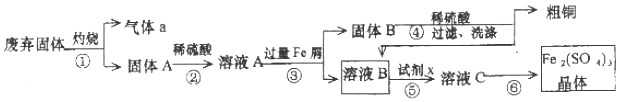
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离乙酸和乙酸乙酯,常用蒸馏法 | |
| B. | 提纯含有碘的氯化铵,常用升华法 | |
| C. | 除去碳酸钠中的少量碳酸氢钠,常用加热法 | |
| D. | 除去CO2中的SO2,通过盛有溴水的洗气瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com