
分析 含有A、B、C、D、E、F的六瓶无色溶液,B、C、D和F是常见金属的盐,且它们的阴离子均不同,
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾,说明A为NH3•H2O;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,可能为Al(OH)3或Mg(OH)2,F中沉淀完全溶解,则F为AgNO3,D可能为Al2(SO4)3或MgSO4;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,D、E中有无色、无味气体逸出,该气体为CO2,说明E为酸溶液,且纯E为无色油状液体,说明E为H2SO4;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶,则该沉淀可能为BaSO4或AgCl,则C应为BaCl2,B可能为Na2CO3或K2CO3,其中一种沉淀在医疗上有非常重要的用途,其密度很大,且能够阻止X射线通过,说明生成硫酸钡沉淀,综上所述,A为NH3•H2O、B为Na2CO3或K2CO3、C为BaCl2、D为Al2(SO4)3或MgSO4、E为H2SO4、F为AgNO3,以此解答该题.
解答 解:①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾,说明A为NH3•H2O;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,可能为Al(OH)3或Mg(OH)2,F中沉淀完全溶解,则F为AgNO3,D可能为Al2(SO4)3或MgSO4;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,D、E中有无色、无味气体逸出,该气体为CO2,说明E为酸溶液,且纯E为无色油状液体,说明E为H2SO4;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶,则该沉淀可能为BaSO4或AgCl,则C应为BaCl2,B可能为Na2CO3或K2CO3,其中一种沉淀在医疗上有非常重要的用途,其密度很大,且能够阻止X射线通过,说明生成硫酸钡沉淀,综上所述,A为NH3•H2O、B为Na2CO3或K2CO3、C为BaCl2、D为Al2(SO4)3或MgSO4、E为H2SO4、F为AgNO3,
(1)C为BaCl2,是强酸强碱盐,所以对水的电离平衡无影响,D为Al2(SO4)3或MgSO4、镁离子或铝离子能水解,对水的电离平衡起促进作用,
故答案为:无影响;促进;
(2)B为Na2CO3或K2CO3,确定溶液B中的阳离子即钾离子或钠离子,可以通过焰色反应鉴定,
故答案为:焰色反应;
(3)在NH3•H2O和AgNO3 中,将氨水滴入硝酸银溶液中,先出现白色沉淀后沉淀溶解,如果将硝酸银溶液滴入氨水溶液中先无明显现象,硝酸银过量则有白色沉淀,据此可以鉴别NH3•H2O和AgNO3,将H2SO4滴入K2CO3溶液中,先无明显现象后有气体出现,如果将K2CO3溶液滴入H2SO4溶液中一开始就有气体产生,据此可以鉴别H2SO4和K2CO3,
故答案为:NH3•H2O和AgNO3;H2SO4和K2CO3;
(4)A为NH3•H2O、E为H2SO4,将等体积、等物质的量浓度的A溶液和E溶液混合,生成NH4HSO4,铵根离子水解,所以反应后溶液中各种离子浓度由大到小的顺序为c(H+)>c(SO42-)>c(NH4+)>c(OH-),
故答案为:c(H+)>c(SO42-)>c(NH4+)>c(OH-);
(5)已知常温下BaSO4的溶解度为2.33×10-4g,则BaSO4的物质的量的浓度为$\frac{\frac{2.33×10{\;}^{-4}g}{233g/mol}}{0.1L}$=1.0×10-5mol/L,则c(Ba2+)=c(SO42-)=1.0×10-5mol/L,所以Ksp(X)=c(Ba2+)•c(SO42-)=1.0×10-10,
故答案为:1.0×10-10.
点评 本题考查无机物的推断,为高考常见题型,题目难度中等,涉及了物质检验、离子方程式书写等知识,注意掌握常见物质的检验方法,能够根据反应现象判断未知物成分,试题培养了学生的分析、理解能力.


科目:高中化学 来源: 题型:解答题
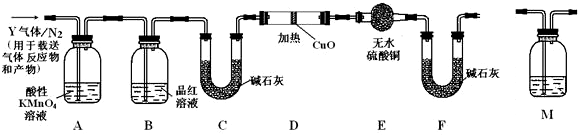
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用高效催化剂 | B. | 充入更多N2 | C. | 降低温度 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
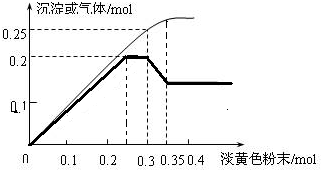 图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答:
图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 室温下,PH=2的溶液中:Fe2+、SO42-、Na+、NO3- | |
| C. | 无色透明的溶液中:NH4+、Cl-、NO3-、Fe3+ | |
| D. | 使红色石蕊试纸变蓝的溶液中:SO32-、Na+、CO32-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现象相同,沉淀量相等 | B. | 现象不同,沉淀量不等 | ||
| C. | 现象相同,沉淀量不等 | D. | 现象不同,沉淀量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com