
����Ŀ������[CO(NH2)2]��һ�ָ�Ч���ʣ�Ҳ��һ�ֻ���ԭ�ϡ�
��1�����º����£���ij�ܱ������г���CO(NH2)2��H2O����120�������������·�����Ӧ��CO(NH2)2 (s) + H2O(g)![]() 2 NH3(g)+CO2(g) ��H >0���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽK= ��
2 NH3(g)+CO2(g) ��H >0���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽK= ��
���ڸ÷�Ӧ������˵����ȷ����
A����������ƽ����Է����������ٸı䣬������Ϊ��ѧƽ���ı�־
B����ƽ����ϵ������ˮ��������ʹ�÷�Ӧ��ƽ�ⳣ������
C�������¶�ʹCO(NH2)2��ת��������
D���ﵽƽ����ٳ�������H2O�����´ﵽƽ�⣬H2O��ת���ʻ��С
��2��һ�������£�ij�ܱ������г�������ʵ�����NH3��CO2��������Ӧ��CO2(g) +2NH3(g)![]() CO (NH2)2 (s) +H2O(g)�����������NH3���������[��(NH3)]��ʱ��仯��ϵ��ͼ��ʾ��
CO (NH2)2 (s) +H2O(g)�����������NH3���������[��(NH3)]��ʱ��仯��ϵ��ͼ��ʾ��
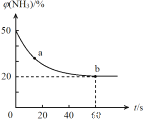
��a�������Ӧ����V��(CO2)_________ b����淴Ӧ����V��(CO2)(�>������=����<��)��������ƽ��ת������___________ ��
���𰸡���1��![]() (2��) ad(2��)
(2��) ad(2��)
��2��>(2��) 75% (2��)
��������
�����������1����ӦCO(NH2)2 (s) + H2O(g)![]() 2 NH3(g)+CO2(g) ��ѧƽ�ⳣ���ı���ʽK=
2 NH3(g)+CO2(g) ��ѧƽ�ⳣ���ı���ʽK=![]() ��a����Ӧ��ϵ���й��壬��Ӧֻ�дﵽƽ��ʱ������������ű��ֲ��䣬��������ƽ����Է����������ٸı䣬��a��ȷ��b��ƽ�ⳣ��ֻ���¶��йأ���b����c�������¶���ƽ�������ƶ���CO(NH2)2��ת�������ͣ���c����d���ﵽƽ����ٳ�������H2O��ƽ�������ƶ���H2O��ת���ʻ��С����d��ȷ����Ϊad��
��a����Ӧ��ϵ���й��壬��Ӧֻ�дﵽƽ��ʱ������������ű��ֲ��䣬��������ƽ����Է����������ٸı䣬��a��ȷ��b��ƽ�ⳣ��ֻ���¶��йأ���b����c�������¶���ƽ�������ƶ���CO(NH2)2��ת�������ͣ���c����d���ﵽƽ����ٳ�������H2O��ƽ�������ƶ���H2O��ת���ʻ��С����d��ȷ����Ϊad��
��2�����������������50%�仯Ϊ20%������������ֲ��䣬˵��B�㷴Ӧ�ﵽƽ��״̬��A�㰱������ٷֺ�������B�İ�������ٷֺ�����˵����Ӧ������дﵽƽ��״̬��A�������Ӧ���ʴ���B�������Ӧ���ʣ���v��(CO2)��v��(CO2)��
�谱��Ϊ50mol��������̼Ϊ50mol���������ĵ����ʵ���x����ʼ�����������Ϊ50%����
2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)
��ʼ��(mol) 50 50 0 0
�仯��(mol) x 0.5x 0.5x 0.5x
ƽ����(mol) 50-x 50-0.5x 0.5x 0.5x
ƽ��ʱ�������������Ϊ20%����![]() =20%�����x=37.5mol��
=20%�����x=37.5mol��
�ʰ�����ƽ��ת����=![]() =75%��
=75%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2008 �걱�����˻ᣬ���ȼ���ǻ���ȼ�� C3H8 �� ����˵������ȷ���ǣ� ��
A.���ñ����ȼ�շ�Ӧ��������Ƴ�ԭ���
B.ѡ�ñ�����ȼ�ϣ����˻����⣬����Ϊ�����³�ѹ����Һ̬�����ڴ���
C.���ȼ��ʱ��������������ת����ʽ
D.C3H8ȼ�շ�Ӧ�з�Ӧ��ļ��ܺʹ�����������ܺ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ����Ũ��Ϊ0.1000 mol��L��1��NaOH��Һ�ζ�25.00 mLŨ�Ⱦ�Ϊ0.1000 mol��L��1��������HX��HY��HZ���ζ�������ͼ��ʾ������˵����ȷ���ǣ�
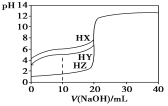
A������ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ�������˳��HZ��HY��HX
B�����ݵζ����ߣ��ɵ�Ka(HY)��1��10��5
C��������HX��HY��Һ�������Ϻ���NaOH��Һ�ζ���HXǡ����ȫ��Ӧʱ��
c(X��)��c(Y��)��c(OH��)��c(H��)
D��HY��HZ��ϣ��ﵽƽ��ʱc(H��)��![]() ��c(Z��)��c(OH��)
��c(Z��)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�������ˮ���˵������ȷ����
A. �κ��ξ��ܷ���ˮ�� B. ��Һ��pH �������
C. ʹˮ�ĵ���̶����� D. ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֻ��NaOH��Һ���ܳ�ȥ���и��������е�����(������Ϊ����)����
A��Mg(Al2O3) B��MgCl2(A1Cl3) C��Mg(Si) D��MgO(SiO2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ԫ��ԭ�ӵ����������Ų�ʽ�����в��ܱ�ʾ��Ԫ��һ��Ϊ����Ԫ�ص��ǣ� ��
A. 3s23p3 B. 4s2 C. 4s24p1 D. 3s23p5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�һ�����ױ�����Ҫ���������ױ��Ͷ������ױ����ķ�Ӧԭ����ʵ��װ
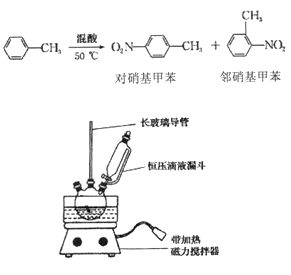
�ܶ�/��g��cm-3) | �е㣯�� | ʽ�� | �ܽ��� | |
�ױ� | 0.866 | 110.6 | 92 | ������ˮ��������һ�����ױ� |
�������ױ� | 1.286 | 237.7 | 137 | ������ˮ��������Һ̬�� |
�������ױ� | 1.162 | 222 | 137 | ������ˮ��������Һ̬�� |
ʵ�鲽�裺
�� ���ƻ��ᣬ��װ��ͼ��Ӧװ�á�ȡ100 mL �ձ�����10 mL Ũ������30 mL Ũ������
�ƻ��ᣬ�����ѹ��Һ©���У���15 mL �ױ����ۺ�����13.0g������������ƿ�С�
�� �������µļױ�����μӻ��ᣬ�ߵα߽��裬��Ͼ��ȡ�
�� ��50һ60�� �·�����Ӧ��ֱ����Ӧ������
�� ��ȥ���������������ˮ��10% NaCO3��Һϴ�ӣ������������ˮϴ�ӵõ��ֲ�Ʒ��
��ش��������⣺
��l������40mL ����IJ�����________________
��2��װ���л�ȱ��__________�����������ƣ�������¶ȳ���60�棬������____�����������ƣ����ɡ�
��3������ֲ�Ʒ��ˮ�IJ���������__________
��4����Ʒ��10% NaCO3��Һϴ��֮����������ˮϴ�ӣ������Ʒ�Ƿ�ϴ�ɾ��IJ�����_______
��5��Ϊ�˵õ�������������������������Һ���м���_______��ȥˮ��Ȼ�����������յõ���Ʒ������Ϊ13.70g����һ�����ױ��IJ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2008��6��1�����������С�ũó�г������ṩ��ѵ����ϴ�������˵���в���ȷ����(����)
A. ��һ�ٴ��Ŀ����Ϊ�����ƺͼ������ϴ���ʹ�������ơ���ɫ��Ⱦ��
B. ���ϡ��ϳ���ά���ϳ���������ϳɲ���
C. ���ͽṹ�����Ͼ���������(���ȱ��Σ���ȴ����)
D. ���ϡ���ά�ء������ʡ���Ȼ��������Ȼ�߷���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com