
����Ŀ��Cl2��һ����Ҫ�Ļ���ԭ�ϣ�������������֪ʶ����������⣮
��1�����������ĸ�ƿ��Ӧ���ı�ǩΪ ��
A.��ʴƷ
B.��ըƷ
C.�ж�Ʒ
D.��ȼƷ
��2����ҵ�Ͻ�����ͨ��ʯ������ȡƯ�ۣ�д���÷�Ӧ�Ļ�ѧ����ʽ ��
��3��Ư�۵���Ч�ɷ��ǣ��ѧʽ�� ��
��4��ʵ���ҿ�����KMnO4��Ũ�����ڳ������Ʊ�Cl2 �� ���������Һ���������ʵĶ��Լ����붨��������ij��ѧ��ȤС����ʵ����������KMnO4����������500mL 0.1mol/L��KMnO4��Һ�� �����õ�������������ƽ��ҩ�ס��ձ�������������Ͳ����ͷ�ιܡ� ��
�����в����ᵼ��ʵ����ƫС����������ĸ����
a��ת��ʱû��ϴ���ձ���������
b������ƿ�ڱڸ���ˮ���δ���ﴦ��
c���ߵ�ҡ�Ⱥ��ְ�Һ����ڿ̶����ּ�ˮ����
d����ˮ����ʱ���ӿ̶���
������õĸ�Ũ�ȵ�KMnO4��Һ��300mL 0.2mol/L��KI��Һǡ�÷�Ӧ�����ɵ����ʵ�����I2��KIO3 �� ������KMnO4�����ΪmL��
��5����ˮ�к��ж��ֳɷ֣�������кܶ����ʣ�������ˮ�ֱ�����ͼ�������ʷ����ķ�Ӧ��� ��a��b��c��d�غϲ��ִ������ʼ䷴Ӧ������ˮ��������֪��Cl2+2Br��=2Cl��+Br2 ����
����֤����ˮ����Ư���Ե������a������b������c����d������������ ��
��a�з�����Ӧ�����ӷ���ʽ�� ��
���𰸡�
��1��C
��2��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O
��3��Ca��ClO��2
��4��500ml����ƿ��ac��320
��5��d����Һ�ȱ�����ɫ��3Cl2+2Fe 2++4Br��=6Cl��+2Fe 3++2Br2
���������⣺��1������Ϊ�ж������壬����и�ƿ��Ӧ���ı�ǩΪC������ȼ���ױ������������и�ʴ�ԣ� ���Դ��ǣ�C����2����ҵ�Ͻ�����ͨ��ʯ������ȡƯ�ۣ�����Ca��ClO��2��CaCl2 �� ���Ի�ѧ����ʽΪ��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
���Դ��ǣ�2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O����3��Ư�۵���Ҫ�ɷ�ΪCa��ClO��2��CaCl2 �� ��Ч�ɷ���Ca��ClO��2 ��
���Դ��ǣ�Ca��ClO��2����4��������500mL 0.1mol/L��KMnO4��Һ��Һ�IJ��裺���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȣ��õ�����������ƽ��ҩ�ס��ձ�������������Ͳ����ͷ�ιܡ�500ml����ƿ�����Ի�ȱʧ��������500ml������ƿ�����Դ��ǣ�500ml����ƿ����a��ת��ʱû��ϴ���ձ������������������ʵ����ʵ�����С������ƫС������ȷ��
b������ƿ�ڱڸ���ˮ���δ���ﴦ������Ӱ�죬�ʴ���
c���ߵ�ҡ�Ⱥ��ְ�Һ����ڿ̶����ּ�ˮ���ϣ�������Ũ��ƫС������ȷ��
d����ˮ����ʱ���ӿ̶��ߣ����ƫС��Ũ�ȱ�ʴ���
��ѡ��a��c��
���Դ��ǣ�ac����n��KI��=0.06mol����һ����������KMnO4��Һǡ�÷�Ӧ�����ɵ����ʵ�����I2��KIO3 �� ��n��I2��=n��KIO3��=0.02mol����ʧȥ���ӵ����ʵ���Ϊ2��0.02mol+0.02mol��[5������1��]=0.16mol��������KMnO4�����ʵ������� ![]() =0.032mol����������KMnO4�����Ϊ320mL��
=0.032mol����������KMnO4�����Ϊ320mL��
���Դ��ǣ�320����5������֤����ˮ����Ư���Ե���ʯ���ȱ�����ɫ��
���Դ��ǣ�d����Һ�ȱ�����ɫ����Cl2��������ˮ����Ҫ�ɷ֣�����ǿ�����ԣ���KBr����������ԭ��Ӧ��3Cl2+2Fe 2++4Br��=6Cl��+2Fe 3++2Br2��
���Դ��ǣ�3Cl2+2Fe 2++4Br��=6Cl��+2Fe 3++2Br2 ��
�����㾫����ͨ��������������Ļ�ѧ���ʺ�������ʵ�����Ʒ������������Ļ�ѧ���ʣ��������Ӧ�����������ɸ�̬���ǽ�����Ӧ����ˮ��Ӧ����Ӧ���뻹ԭ�����ʷ�Ӧ��ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O�����Խ����⣮


 Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ÿ�����ʷ���ת�����˷������Ӽ�����������ͬ�����͵��ǣ� ��
A. ��ɱ�����B. �Ȼ��Ƶ��ۻ�������ڻ�
C. �Ȼ���;ƾ�����ˮD. CO2����ͨ�����ʯ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ѧϰС����ճ������в���ȱ�ٵĵ�ζƷM����̽������֪C����D��ȼ�շ�����ɫ���森M���������ʵ�ת����ϵ��ͼ1��ʾ�����ֲ�������ȥ���� 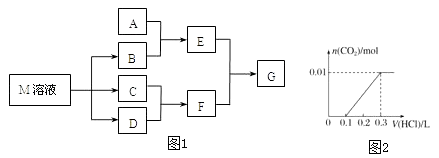
��1��д���ö��Ե缫���M��Һ�����ӷ���ʽ �� д��F�ĵ���ʽ
��2����A��һ�ֳ���������������ҿ��������첣����E��Һ��F��Һ��Ӧ�����Ʊ�һ�ֽ��壬��E��Һ���׳��� ��
��3����A��CO2���壬A��B��Һ�ܹ���Ӧ����Ӧ�����õ���Һ�������ᷴӦ����ͼ��ʾ����A��B��Һ��Ӧ����Һ�е����ʻ�ѧʽΪ ��
��4����A��һ�ֳ����������ʣ���A��B��Һ�ܹ���Ӧ��������F��Һ��μ���E��Һ���ӱ�����������ʵ��������
��5����A��һ�ֲ��ȶ����Σ�A��Һ��B��Һ��Ͻ�������ɫ��״������˲���Ϊ����ɫ������ɺ��ɫ��E����G��Һ�м��뱽����Һ������ɫ������Aת����E�����ӷ���ʽ�� ��
��6����A��һ�ֻ��ʣ�ʵ���ҿ���A��B��Ӧ��ȡ����E��E��F��E��D������ð���̣�������E��D�ķ�Ӧ��������D�Ĺܵ��Ƿ�й¶��д��E��D��Ӧ�Ļ�ѧ����ʽ�� ��
��7����A��һ����Һ��ֻ���ܺ���H+��NH4+��Mg2+��Fe3+��Al3+��CO32����SO42���е�ijЩ���ӣ��������Һ�м���B��Һʱ�������ɳ��������ʵ�����B��Һ����������仯��ͼ2��ʾ���ɴ˿�֪������Һ�п϶����е����Ӽ���Ũ��֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC5H10��ϩ������ͬ���칹�壨Ҫ����˳���칹�壩�� ��
A.5��
B.6��
C.7��
D.8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�о�ij������Ũ���ᷴӦ��������Y�ijɷ֣�ijѧϰС���������裬��Ϊ���������г�����SO2�⣬�����ܺ���H2��Q���壬�����������ʵ��װ�ã�ͼ�мг�����ʡ�ԣ�̽������ijɷ֣�Ϊȷ��Q�Ĵ��ڣ�����װ��������M�ڣ� �� 
A.A��B֮ǰ
B.B��C��
C.C��D��
D.D��E��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�пɷ�������������Ӧ��Ce4++Fe2+ = Fe3++Ce3+��Sn2++2Fe3+ = 2Fe2++Sn4+�ɴ˿���ȷ��Fe2+��Ce3+��Sn2+�������ӵĻ�ԭ����ǿ������˳����
A. Sn2+��Fe2+��Ce3+ B. Ce3+��Fe2+��Sn2+
C. Sn2+��Ce3+��Fe2+ D. Fe2+��Sn2+��Ce3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ50.0mLNa2CO3��Na2SO4�Ļ����Һ���������BaCl2��Һ��õ�14.51g��ɫ�������ù���ϡ���ᴦ������������ٵ�4.66g����������ų����Լ��㣺
��1��ԭ���Һ��CO32�������ʵ���Ũ��Ϊ �� Na+�����ʵ���Ũ��Ϊ ��
��2�������������ڱ�״���µ����L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ܷ���ˮ�ⷴӦ���� ( )
A. ������ B. ������ C. ��֬ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��������������Ӧ�ù㷺�����з�Ӧ������������ԭ��Ӧ���ǣ� ��
A.ľ̿ȼ�գ�C+O2 ![]() CO2
CO2
B.����ʯ��ʯ��CaCO3 ![]() ?CaO+CO2��
?CaO+CO2��
C.����ұ����Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
D.���ˮ��2H2O ![]() 2 H2��+O2��
2 H2��+O2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com