
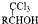
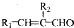 (R、R1、R2代表烃基或氢原子)
(R、R1、R2代表烃基或氢原子) ;
;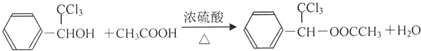 ;
;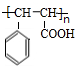 ;
;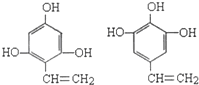 .
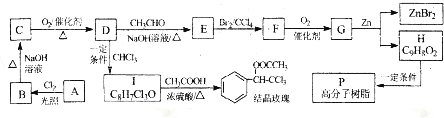
.分析 A的分子式为C7H8,A系列转化得到结晶玫瑰,由结晶玫瑰的结构简式,可知A为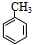 ,A与氯气在光照条件下发生甲基上取代反应生成B,B发生卤代烃的水解反应生成C,C发生催化氧化得到D,D发生信息中反应得到I,则D中含有醛基,故D为
,A与氯气在光照条件下发生甲基上取代反应生成B,B发生卤代烃的水解反应生成C,C发生催化氧化得到D,D发生信息中反应得到I,则D中含有醛基,故D为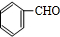 ,C为
,C为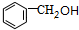 ,B为
,B为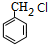 ,结合信息可知,I为
,结合信息可知,I为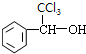 ,E为
,E为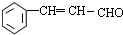 ,I与乙酸发生酯化反应得到结晶玫瑰.E与溴发生加成反应生成得到F为
,I与乙酸发生酯化反应得到结晶玫瑰.E与溴发生加成反应生成得到F为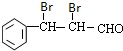 ,F氧化生成G为
,F氧化生成G为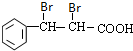 ,H为
,H为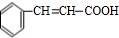 ,H发生加聚反应得到P为
,H发生加聚反应得到P为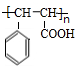 .
.
解答 解:A的分子式为C7H8,A系列转化得到结晶玫瑰,由结晶玫瑰的结构简式,可知A为 ,A与氯气在光照条件下发生甲基上取代反应生成B,B发生卤代烃的水解反应生成C,C发生催化氧化得到D,D发生信息中反应得到I,则D中含有醛基,故D为
,A与氯气在光照条件下发生甲基上取代反应生成B,B发生卤代烃的水解反应生成C,C发生催化氧化得到D,D发生信息中反应得到I,则D中含有醛基,故D为 ,C为
,C为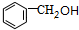 ,B为
,B为 ,结合信息可知,I为
,结合信息可知,I为 ,E为
,E为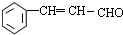 ,I与乙酸发生酯化反应得到结晶玫瑰.E与溴发生加成反应生成得到F为
,I与乙酸发生酯化反应得到结晶玫瑰.E与溴发生加成反应生成得到F为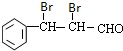 ,F氧化生成G为
,F氧化生成G为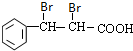 ,H为
,H为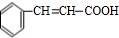 ,H发生加聚反应得到P为
,H发生加聚反应得到P为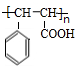 .
.
(1)C为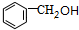 ,名称为苯甲醇,E为
,名称为苯甲醇,E为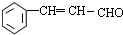 ,含有的官能团为醛基、碳碳双键,
,含有的官能团为醛基、碳碳双键,
故答案为:苯甲醇;醛基、碳碳双键;
(2)①D→I的反应类型为加成反应,
②B→C的化学方程式为: ,
,
故答案为:加成反应; ;
;
(3)由I生成结晶玫瑰的化学方程式为: ,
,
故答案为: ;
;
(4)①在上述流程中“E→F”及“G→H”在P的合成过程中的作用是:保护碳碳双键,防止被氧化,
②高分子P的结构简式为: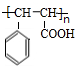 ,
,
故答案为:保护碳碳双键,防止被氧化;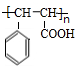 ;
;
(5)I在一定条件下水解生成J(C8H8O3),则J为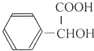 ,J的同分异构体满足条件:a.遇氯化铁溶液发生显色反应,说明含有酚羟基与苯环,b.苯环上的一氯取代物只有一种,c.与足量的氢氧化钠溶液反应,1mol该物质可消耗3mol NaOH,符合条件的同分异构体为:
,J的同分异构体满足条件:a.遇氯化铁溶液发生显色反应,说明含有酚羟基与苯环,b.苯环上的一氯取代物只有一种,c.与足量的氢氧化钠溶液反应,1mol该物质可消耗3mol NaOH,符合条件的同分异构体为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,注意根据结晶玫瑰的结构简式、给予的信息与反应条件进行推断,熟练掌握官能团的性质与转化,侧重考查学生自学能力、知识迁移运用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
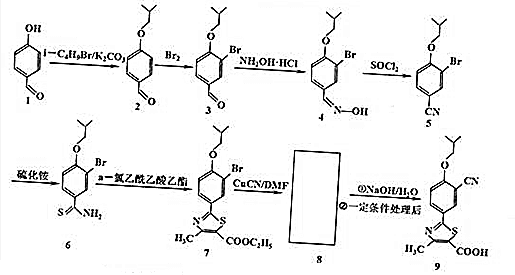
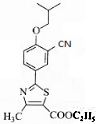 .
.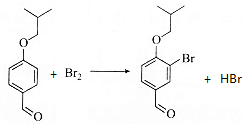 .
. .
.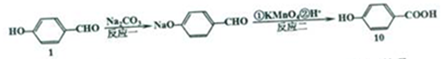
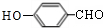 +Na2CO3→
+Na2CO3→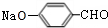 +NaHCO3,其目的是保护酚羟基,防止为氧化.
+NaHCO3,其目的是保护酚羟基,防止为氧化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠 (NaN3) 常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚.
叠氮化钠 (NaN3) 常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液与K+、NO3-、OH-可以大量共存 | |
| B. | 该溶液显碱性的原因为ClO-+H2O?HClO+OH- | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O2-结构示意图: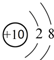 | |
| B. | 硝基苯的结构简式: | |
| C. | NaHSO4熔融时电离方程式:NaHSO4═Na++HSO4- | |
| D. | 模型 可表示甲烷分子或四氯化碳分子 可表示甲烷分子或四氯化碳分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
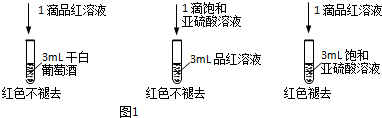
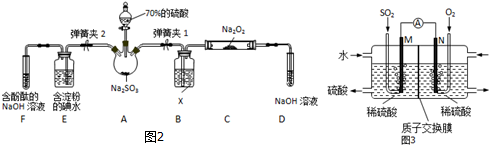
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com