
【题目】思维辨析:
(1)互为同分异构体的不同物质相对分子质量相等,相对分子质量相等的不同物质一定互为同分异构____。
(2)氰酸(H—O—C≡N)和雷酸(H—N==C==O)都是无机物,它们互为同分异构体____。
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】(1)SO2和NOx都是大气污染物。采取还原法,用炭粉可将氮氧化物还原。
已知:N2(g)+O2(g) = 2NO(g)ΔH=+180.6 kJ·mol-1
C(s)+O2(g) = CO2(g)ΔH=-393.5 kJ·mol-1
则反应C(s)+2NO(g) = CO2(g)+N2(g) ΔH=________kJ·mol-1。
(2)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被NH4HSO3溶液吸收的离子方程式是_____________________________。
(3)家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出表示丁烷燃烧的热化学方程式:____________。
(4)已知:C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为______。
(5)在一定条件下,可逆反应:mA+nBpC达到平衡,若:
①A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n__p。(填< > =)
②A、C是气体,增加B的量,平衡不移动,则B为______态。
③A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是___
④加热后,可使C的质量增加,则正反应是_____反应(填“放热”或“吸热”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是—种极强的氧化剂,常应用于饮用水处理,其工业制备方法如图所示:

(1)高铁酸钾中铁元素的化合价是__________价。
(2)反应I的目的是________________________________。
(3)反应II的离子方程式为________________________________。
(4)洗涤粗品时选用乙醇而不用水的理由是________________________________。
(5)己知生成高铁酸钾的反应为Na2FeO4+2KOH![]() K2FeO4↓+2NaOH,请你解释加入饱和KOH溶液能生成高铁酸钾的理由是_________________________。
K2FeO4↓+2NaOH,请你解释加入饱和KOH溶液能生成高铁酸钾的理由是_________________________。
(6)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K2FeO4)进行消毒、净化以及改善水质,其消毒原理是______________________。
(7)可用亚铬酸盐滴定法测定高铁酸钾含量,滴定时有关反应的离子方程式为:
①FeO42-+CrO2-+2H2O==CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+=CrO72-+H2O
③CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
现称取2.084g高铁酸钾样品溶于适量NaOH溶液中,加入稍过量的NaCrO2,充分反应后过滤,滤液在250mL容量瓶中定容。每次取25.00mL加入稀硫酸酸化,用0.1000mol·L-1的FeSO4标准溶液滴定,三次滴定消耗标准溶液的平均体积为20.00mL。则上述样品中K2FeO4 的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】已知:①H2(g)+ ![]() O2(g)=2H2O(g) △H1=akJ/mol
O2(g)=2H2O(g) △H1=akJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=b kJ/mol
③H2(g)+ ![]() O2(g)=H2O(l) △H3=ckJ/mol;
O2(g)=H2O(l) △H3=ckJ/mol;
④2H2(g)+O2(g)=2H2O(l) △H4=dkJ/mol。
下列关系正确的是
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。电池总反应为:2CH3OH+3O2→2CO2+4H2O。下列说法正确的是( )

A. 左电极为电池的负极,a处通入的物质是空气
B. 右电极为电池的负极,b处通入的物质是甲醇
C. 负极反应式为:CH3OH+H2O-6e-= CO2+6H+
D. 正极反应式为:O2+2H2O -4e-= 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:
①取一定量的该烃,使其充分燃烧后的气体通过装有CaCl2干燥管,干燥管增重7.2g;再通过石灰水,石灰水增重17.6g。
②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
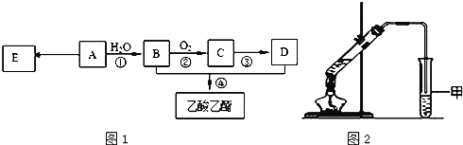
(1)0.1mol该烃A能与 _____g溴发生加成反应;加成产物需 _____mol溴蒸气完全取代;
(2)B中官能团的名称是_____, B可通过加入强氧化剂为_______(任填一种)一步直接氧化为D。
(3)E是常见的高分子材料,写出E的结构简式______;合成E的反应类型______;
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是__________;
②上述实验中饱和碳酸钠溶液的作用是________;
③在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是_____。
(5)比乙酸乙酯相对分子质量大14的酯有_____种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,1 mol H2和1 mol O2,下列有关它们的说法正确的是
A. 质量相同,体积不同 B. 分子数相同,质量不同
C. 体积相同,分子数不同 D. 体积相同,原子数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 已知t1 ℃时,反应C+CO2![]() 2CO ΔH>0的速率为v,若升高温度逆反应速率减小
2CO ΔH>0的速率为v,若升高温度逆反应速率减小
B. 恒压容器中发生反应N2+O2![]() 2NO,若在容器中充入He,正逆反应的速率均不变
2NO,若在容器中充入He,正逆反应的速率均不变
C. 当一定量的锌粉和过量的6 mol·L-1盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向反应器中加入一些水、CH3COONa溶液或NaNO3溶液
D. 对任何一个化学反应,温度发生变化,化学反应速率一定发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中,从海带里提取碘的部分流程如下图,下列说法不正确的是

A. 步骤①灼烧海带需要用坩埚
B. 步骤③主要操作为过滤
C. 步骤④主要反应为:2I-+H2O2+2H+=2H2O+I2
D. 步骤⑤可以加入酒精萃取I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com