
【题目】下列关于甲烷的叙述错误的是( )
A. 天然气的主要成分B. 最简单的有机物
C. 含碳质量分数最大的有机物D. 与氯气在光照条件下能发生取代反应
科目:高中化学 来源: 题型:
【题目】【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. c(N2):c(H2):c(NH3)=1:3:2
B. N2、H2和NH3的物质的量分数不再改变
C. N2与H2的物质的量之和是NH3的物质的量的2倍
D. 单位时间里每增加lmolN2,同时增加3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配平下列反应的化学方程式,标出电子转移方向和数目,并回答有关问题:
Na2Cr2O7+KI+HCl →CrCl3 +NaCl +KCl+I2 + __________ __________。
(1)上面反应中氧化剂是____,被氧化的元素是___。
(2)HCl的作用___。
(3)若反应过程中有0.50molI2被氧化出来,且有__mol电子发生了转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同质量的SO2和SO3,它们之间的关系正确的是
A.所含硫原子的物质的量之比为1:1
B.所含硫元素的质量比为5:4
C.所含氧元素的质量比为4:5
D.所含氧原子的物质的量之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图:

(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是______。
(2)第②步操作的目的是除去粗盐中的______(填化学式,下同),第⑥步操作的目的是除去滤液中______。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、______(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是______。
(5)实验所得精盐的质量大于粗盐中NaCl的质量,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯水中存在的平衡:H2O ![]() H+ + OH-,其电离平衡曲线如图所示,下列说法不正确的是( )
H+ + OH-,其电离平衡曲线如图所示,下列说法不正确的是( )

A. A、C两点可能为纯水
B. 若从A点到C点,可采用:升高温度,在水中加入少量氯化钠固体
C. 若从C点到D点,可采用:降低温度,在水中加入少量硫酸氢钠固体
D. 若从A点到D点,可采用:温度不变,在水中加入少量碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,在两个容积相同的容器中,一个盛有CO气体,另一个盛有CO2气体,则两容器内的气体一定具有相同的
A.密度 B.原子数 C.质量 D.分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
A. 体系平衡时与反应起始时的压强之比为5∶6
B. 反应在前50 s 的平均速率ν(PCl3)= 0. 0032 mol·L-1·s-1
C. 相同温度下,起始时向容器中充入0.6mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到平衡前ν(正)>ν(逆)
D. 相同温度下,若起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的质量分数比上述平衡体系小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283 kJ/mo1,则CO的燃烧热的热化学方程式为___________________________________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116kJ/mo1
CH3OH(g) ΔH=-116kJ/mo1
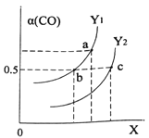
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_____________,Y1_____Y2(填“<”、“=”、“>”)。
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①反应进行到4min时,v(正)____v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=____________mol·L1·min1。
②该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com