
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
A. 体系平衡时与反应起始时的压强之比为5∶6
B. 反应在前50 s 的平均速率ν(PCl3)= 0. 0032 mol·L-1·s-1
C. 相同温度下,起始时向容器中充入0.6mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到平衡前ν(正)>ν(逆)
D. 相同温度下,若起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的质量分数比上述平衡体系小
【答案】D
【解析】
A、 PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
起始: 1.0 0 0
变化: 0.2 0.2 0.2
平衡: 0.8 0.2 0.2 相同条件下,气体的压强之比等于其物质的量之比,即P前:P后=1.0:1.2=5:6,故A错误;
B、根据化学反应速率的数学表达式,v(PCl3)=0.16/(2×50)mol/(L·s)=0.0016mol/(L·s),故B错误;
C、根据选项A,此温度下化学平衡常数K=![]() =0.025,相同温度下,起始时向容器中充入0.6mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,此时的浓度商Q=
=0.025,相同温度下,起始时向容器中充入0.6mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,此时的浓度商Q=![]() 0.03>0.025,说明反应向逆反应方向进行,即v逆>v正,故C错误;
0.03>0.025,说明反应向逆反应方向进行,即v逆>v正,故C错误;
D、充入2.0molPCl3和2.0molCl2,可以看作先通入1.0molPCl3和1.0molCl2,达到平衡时,PCl3的质量分数与原平衡PCl3的质量分数相等,然后再通入1.0molPCl3和1.0molCl2,相当于在原来基础上增大压强,PCl3的转化率增大,PCl3的质量分数减小,故D正确。


科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.二氧化锰和浓盐酸共热:MnO2+4H++4Cl-=Mn2+ + Cl2↑+ 2H2O+2Cl-
D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl-=2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷的叙述错误的是( )
A. 天然气的主要成分B. 最简单的有机物
C. 含碳质量分数最大的有机物D. 与氯气在光照条件下能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
B. 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-akJ·mol-1,则中和热为a/2kJ·mol-1
C. 2H2(g)+O2(g)=2H2O(l);△H1=-akJ·mol-1,则氢气燃烧热为akJ·mol-1
D. N2(g)+3H2(g)=2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )
A. 0.20 mol·L-1B. 0.25 mol·L-1
C. 0.40 mol·L-1D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向密闭容器中加入 X物质,发生反应3X(g)![]() Y(g)+Z(g) ΔH<0,反应一定时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示,下列说法中不正确的是
Y(g)+Z(g) ΔH<0,反应一定时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示,下列说法中不正确的是
反应时间(min) | 0 | 5 | 15 | 17 | 20 |
X的浓度(mol/L) | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
A. 0~5min时,该反应的速率为v(X)=0.12 mol/(L·min)
B. 15min时改变的条件不可能是升高温度
C. 5min时反应达到第一次平衡,该温度下的平衡常数数值为0.625
D. 从初始到18min时,X的转化率为30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)O2和O3是氧元素的两种单质。根据分子式回答。等质量的O2和O3的物质的量之比为____,原子个数比为_____。
(2)NO2和N2O4是氮元素的两种常见氧化物,常温下都是气体,它们之间在常温下就能相互转化,因而经常见到的是两种气体的混合物。现取46g该气体,所含氮原子的物质的量为_____。
(3)已知三种物质NaCl、MgCl2、AlCl3分别溶于水,若溶液中的钠、镁、铝三种元素的质量比为23︰16︰9。则:
①NaCl、MgCl2、AlCl3三种物质的物质的量之比为_____;
②其中所含Cl-物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯.现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中Ca2+、Mg2+、SO42-。提纯时的操作步骤和加入试剂的情况如图1。

图1中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)沉淀A的名称是____。
(2)试剂d是____;判断试剂d已经足量的方法是____。
(3)加入b、c后溶液中发生的化学反应的化学方程式为____。
(4)现有图2所示仪器,过滤出沉淀A、B、C时必须用到的是___(填序号)。
Ⅱ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要图2仪器中的____(填序号),该仪器名称为____,向该碘水中加入四氯化碳以提取碘单质的实验操作叫做____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。下列流程采用废旧锂离子电池正极材料(正极一般以铝箔作为基底,两侧均匀涂覆正极材料,正极材料包括一定配比的正极活性物质,如钴酸锂、磷酸铁锂、锰酸锂和三元材料等)制备镍钴锰酸锂三元正极材料(![]() )
)![]() )
)
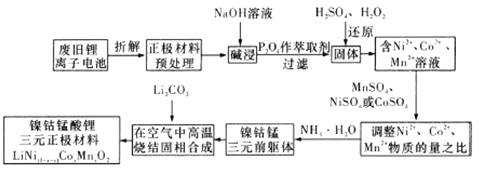
回答下列问题:
(1)写出正极碱浸过程中的离子方程式:________________;能够提高碱浸效率的方法有____________(至少写两种)。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_________________。
(3)![]() 中
中![]() 元素化合价为_______________,其参与“还原”反应的离子方程式为___________。
元素化合价为_______________,其参与“还原”反应的离子方程式为___________。
(4)溶液温度和浸渍时间对钴的浸出率影响如图所示:

则浸出过程的最佳条件是___________________。
(5)已知溶液中![]() 的浓度为
的浓度为![]() ,缓慢通入氨气,使其产生
,缓慢通入氨气,使其产生![]() 沉淀,列式计算
沉淀,列式计算![]() 沉淀完全时溶液的
沉淀完全时溶液的![]() ______________________(已知离子沉淀完全时
______________________(已知离子沉淀完全时![]() ,溶液体积变化忽略不计)
,溶液体积变化忽略不计)
(6)写出“高温烧结固相合成”过程的化学方程式:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com