
【题目】100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )
A. 0.20 mol·L-1B. 0.25 mol·L-1
C. 0.40 mol·L-1D. 0.50 mol·L-1
【答案】C
【解析】
根据n=cV计算各溶液中溶质的物质的量,进而计算各自含有SO42-离子物质的量,两溶质含有的SO42-的物质的量之和为混合溶液中SO42-离子的物质的量,根据公式c=![]() 来计算SO42-离子的物质的量浓度。
来计算SO42-离子的物质的量浓度。
100mL0.3molL-1Na2SO4溶液中含有SO42-的物质的量为:0.3mol/L×0.1L=0.03mol,50mL0.2molL-1Al2(SO4)3溶液中含有SO42-的物质的量为:0.2mol/L×0.05L×3=0.03mol,混合液中含有硫酸根离子的总物质的量为0.06mol,则混合液中硫酸根离子的物质的量浓度为![]() =0.4mol/L,故选C。
=0.4mol/L,故选C。


科目:高中化学 来源: 题型:
【题目】下列指定溶液中,各组离子可能大量共存的是
A. 使石蕊变红的溶液中:Na+、Cl-、SO42-、AlO2-
B. 在中性溶液中:Na+、Al3+、Cl-、HCO3-
C. 由水电离出的c(H+)=10-13 mol·L-1的溶液中:Mg2+、Cl-、K+、SO42-
D. 常温下pH=13的溶液中:NH4+、Ca2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图:

(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是______。
(2)第②步操作的目的是除去粗盐中的______(填化学式,下同),第⑥步操作的目的是除去滤液中______。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、______(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是______。
(5)实验所得精盐的质量大于粗盐中NaCl的质量,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,在两个容积相同的容器中,一个盛有CO气体,另一个盛有CO2气体,则两容器内的气体一定具有相同的
A.密度 B.原子数 C.质量 D.分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为
2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) △H=-1077 kJ·mol-1。
已知相关反应的化学键键能数据如下表所示:
化学键 | N-H | N-N |
| O-H |
E/(kJ·mol-1) | 390 | 190 | 946 | 460 |
①使1 mol N2O4(g)分子中化学键完全断裂时需要吸收的能量是________________。
②下列能说明2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) △H 达平衡状态的是________
a.混合气体的平均相对分子质量不变 b.V(N2)=3V( N2O4)
c.N2H4的质量保持不变 d. △H不再变化
(2)N2O4与NO2之间存在反应N2O4(g) ![]() 2NO2(g)。将一定量的N2O4放人恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如下图所示。
2NO2(g)。将一定量的N2O4放人恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如下图所示。

①由图推测该反应的△H_______0(填>”或“<”),理由为____________________________。
②图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,则该温度下反应的平衡常数Kp=________________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)电解NO2制备NH4NO3,其工作原理如下图所示。

①阴极的电极反应式为____________________________________________________。
②为使电解产物全部转化为NH4NO3,需补充某种化合物——物质A,则A的化学式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
A. 体系平衡时与反应起始时的压强之比为5∶6
B. 反应在前50 s 的平均速率ν(PCl3)= 0. 0032 mol·L-1·s-1
C. 相同温度下,起始时向容器中充入0.6mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到平衡前ν(正)>ν(逆)
D. 相同温度下,若起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的质量分数比上述平衡体系小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M(NO3)2热分解化学方程式为2M(NO3)2![]() 2MO+4NO2↑+ O2↑,加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11.2 L的气体,那么M的摩尔质量是
2MO+4NO2↑+ O2↑,加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11.2 L的气体,那么M的摩尔质量是
A.24 g·mol-1B.74 g·mol-1
C.148 g·mol-1D.40 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2![]() 2NH3。下列有关说法正确的是( )
2NH3。下列有关说法正确的是( )
A. 达到化学平衡时,正反应和逆反应的速率都为零
B. 当符合:3正N2=正H2时,反应达到平衡状态
C. 达到化学平衡时,单位时间消耗a molN2,同时生成3a molH2
D. 当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A可以从煤干馏得到的煤焦油中分离出来,以A为原料可以合成聚邻氨基苯甲酸、扁桃酸等物质,其合成流程如下(部分产物、合成路线、反应条件已略去):
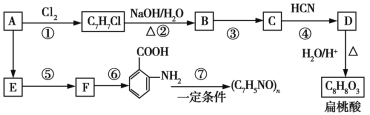
已知:
Ⅰ.R—CHO+HCN![]()
![]()
Ⅱ.R—CN![]() R—COOH
R—COOH
Ⅲ.![]()
![]()
![]() (苯胺易被氧化)
(苯胺易被氧化)
请回答下列问题:
(1)C的分子式为__________。
(2)下列对相关反应类型的判断合理的是__________ (填序号)。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
Ⅰ | 加成 | 水解 | 还原 | 取代 | 还原 | 氧化 | 加聚 |
Ⅱ | 加成 | 消去 | 还原 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅲ | 取代 | 水解 | 加成 | 氧化 | 还原 | 缩聚 | |
Ⅳ | 取代 | 消去 | 氧化 | 取代 | 还原 | 氧化 | 加聚 |
(3)写出反应③的化学方程式:______________________________。
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有__________种,写出其中一种的结构简式:__________________。
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:

①冬青油的结构简式为____________________。
②写出反应Ⅴ的化学方程式:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com