
【题目】(1)白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1。
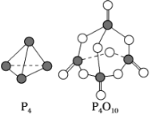
根据图示的分子结构和有关数据估算该反应的ΔH为________________。
(2)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(白磷,s)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+5/4O2(g)===1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
相同状况下,能量较低的是________;白磷的稳定性比红磷________(填“大”或“小”)。
【答案】(6a+5d-4c-12b)kJ·mol-1 红磷小
【解析】
(1)反应热△H=反应物总键能-生成物总键能,据此计算判断;
(2)根据盖斯定律可以计算化学反应的焓变,进而书写热化学方程式,比较能量高低;物质具有的能量越低越稳定。
(1)各化学键键能为P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。反应热△H=反应物总键能-生成物总键能,所以反应P4+5O2=P4O10的反应热△H=6akJmol-1+5dkJmol-1-(4ckJmol-1+12bkJmol-1)=(6a+5d-4c-12b)kJ·mol-1;
(2)已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
根据盖斯定律可知①-②×4即得到反应P4(白磷,s)=4P(红磷,s)的ΔH=-29.2 kJ·mol-1,这说明白磷转化为红磷放热,因此相同状况下,能量较低的是红磷;根据能量越低越稳定可知白磷的稳定性比红磷小。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)1 mol C2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411 kJ能量: 。
(2)1 mol C2H5OH(l)与适量O2(g)反应生成CO2(g)和H2O(l),放出1366.8 kJ热量: 。
(3)2 mol Al(s)与适量O2(g)发生反应生成Al2O3(s),放出1669.8 kJ热量: 。
(4)在200°C、101 kPa时,1 mol H2与碘蒸气作用生成HI气体,放出14.9 kJ热量: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙炔与苯蒸气完全燃烧的热化学方程式如下:
①C2H2(g)+![]() O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
②C6H6(g)+![]() O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
下列说法正确的是 ( )。
A. 1 mol C2H2(g)完全燃烧生成气态水时放热大于1 300 kJ
B. 1 mol C6H6(l)完全燃烧生成液态水时放热大于3 295 kJ
C. 相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多
D. C2H2(g)三聚生成C6H6(g)的过程属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、M、G五种短周期元素,原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性。请回答下列问题:
(1)Y在元素周期表中的位置为___________;
(2) W、Y、Z、G形成的简单离子的半径大小顺序是___________(用化学符号表示)
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有________ (任写两个)
(4)ZW的电子式为___________,W2Y2的电子式为______
(5)MY2和G2均能使品红溶液褪色,常温常压下若将相同体积的MY2和G2气体同时通入品红溶液,请用相关离子方程式解释原因________。
(6)已知
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是是___________ ;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(7)最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是___________ 。

A.N4属于一种新型化合物 B.N4晶体熔点高,硬度大
C.相同质量的N4的能量高于N2 D.1molN4转变为N2将吸收882kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
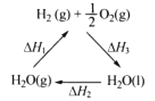
下列说法不正确的是
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示:
C(g)+D(g)过程中的能量变化如图所示:

完成下列填空:
(1)该反应是__________反应(选填“吸热”、“放热”),该反应化学平衡常数表达式为K=____。
(2)在恒温恒容条件下,能判断该反应达到平衡状态的依据是____________。(用文字表示)
(3)若在体系中加入合适的催化剂,则该反应的化学反速率_________,反应的热效应_____(均选填“增大”、“减小”或“不变”)。
(4)达到平衡时,改变一个条件,化学平衡常数不变,A的转化率增大,则该条件是_______。
(5)FeCl3固体溶于蒸馏水常会出见浑浊,得不到澄清的氧化铁溶液。其原因是_________,如果要得到澄清的氯化铁溶液,可采取的措施是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O
C. NaHSO4溶液与Ba(OH)2溶液混合后呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D. 二氧化锰和浓盐酸共热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硫元素的同素异形体的性质相同
B.H2O2常做氧化剂,只有氧化性
C.向CaCl2溶液中通入CO2气体,有白色沉淀生成
D.汽车尾气中的NO主要是氮气和氧气在汽车汽缸中形成的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com