
【题目】2 mol A与2 mol B混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g) ![]() 2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=v(D)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为75%
D.反应前与2 s后容器的压强比为4∶3
【答案】C
【解析】A的起始量为2 mol,转化50%即转化1 mol,根据反应关系知B转化1.5 mol,C生成1 mol,又因为v(D)=0.25 mol·L-1·s-1,可计算出2 s时D的生成量为0.25 mol·L-1·s-1×2L×2 s=1 mol,故知z=2,B项错误;v(C)=v(D)=v(A)=0.25 mol·L-1·s-1,故A项错误;B的转化率为![]() ×100%=75%,C项正确;反应达2 s时,容器内总物质的量为nA+nB+nC+nD=1 mol+0.5 mol+1 mol+1 mol=3.5 mol。故反应前后的容器中气体总物质的量之比为4∶3.5,压强比为4∶3.5,D项 错误。
×100%=75%,C项正确;反应达2 s时,容器内总物质的量为nA+nB+nC+nD=1 mol+0.5 mol+1 mol+1 mol=3.5 mol。故反应前后的容器中气体总物质的量之比为4∶3.5,压强比为4∶3.5,D项 错误。


科目:高中化学 来源: 题型:
【题目】下列物质的分离方法不正确的是( )
A.用重结晶的方法除去硝酸钾中混有少量的氯化钾
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用过滤的方法除去食盐溶液中的泥沙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应CaO + 3C→CaC2 + CO,下面哪种表述能最好地说明该反应是一个氧化还原反应
A.CaO失氧变为CaC2
B.C的状态发生了变化
C.Ca的化合价在反应前后发生了改变
D.C失去了电子,同时也得到了电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是重要的半导体材料,应用于航空航天测控、光纤通讯等领域.一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下: 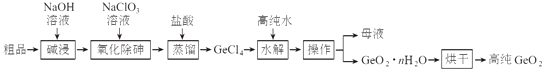
已知:①“碱浸”过程中的反应为:
GeO2+2NaOH═Na2GeO3+H2O
As2O3+2NaOH═2NaAsO2+H2O
②“蒸馏”过程中的反应为:Na2GeO3+6HCl═2NaCl+GeCl4+3H2O
③GeCl4的熔点为﹣49.5℃,AsCl3与GeCl4的沸点分别为130.2℃、84℃.
(1)锗的原子序数为32,锗在元素周期表中的位置为第周期族.
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4 , 其反应方程式为: .
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是 .
(4)工业上与蒸馏操作相关的设备有
A.蒸馏釜
B.离心萃取机
C.冷凝塔
D.加压过滤机
(5)“水解”操作时发生的化学反应方程式为 , “水解”操作时保持较低温度有利于提高产率,其最可能的原因是(答一条即可).
(6)若1吨二氧化锗粗品(含杂质30%)经提纯得0.745吨的高纯二氧化锗产品,则杂质脱除率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H8的两种同分异构体X和Y.X是一种芳香烃,分子中只有一个环;Y是立方体结构,俗称立方烷,其核磁共振氢谱显示只有一个吸收峰.下列有关说法错误的是( )
A.X,Y均能燃烧,都有大量浓烟产生
B.X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应
C.Y中含有碳碳双键
D.Y的二氯代物有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
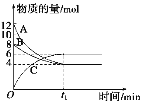
(1)反应的化学方程式为__________________。
(2)从开始到t1 min末时,用物质C表示的反应速率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学通过下列流程制取不溶于水和稀琉酸的黄钾铵铁矾[KNH4Fex(SO4)y(OH)z],并通过实验测定样品中黄钾铵铁矾的有关组成. 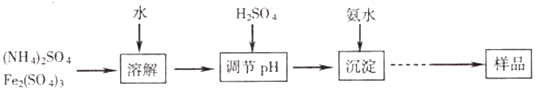
实验测定:
①称取一定质量的样品加入稀盐酸中充分溶解,将所得溶液转移至容器瓶并配制成l00.00mL 溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32g.
③量取25.00mL溶液A,加入足量KI,用2.000molL﹣1Na2S2O3溶液进行滴定(已知反应为I2+2Na2S2O3═2NaI+Na2S4O6 , 消耗30.00mL Na2S2O3溶液至终点.
(1)在[KNH4Fex(SO4)y(OH)z]中x、y、z的代数关系式为 .
(2)若加入H2SO4将pH调节为2,则溶液c(Fe3+ )应为molL﹣1(已知Ksp[Fe(OH)3])=4.0x10﹣38)
(3)实验测定②,检验沉淀是否完全的方法是 .
(4)根据以上实验数据计算样品中的n(Fe3+):n(SO42﹣)(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A.钠钾合金和镁铝合金都是密度小、硬度大的合金
B.玉米制乙醇、蛋白质变性和纳米银粒子的聚集都是化学变化
C.石油化工的裂解气可以作为溴水提取溴单质的萃取剂
D.中国古代采用加热胆矾或者绿矾的方法制取硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ /mol;HCl(aq)与NaOH(aq)反应的△H =-55.6kJ/ mol。则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ /mol B. -43.5kJ /mol C. +43.5 kJ/ mol D. +67.7 kJ/ mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com