
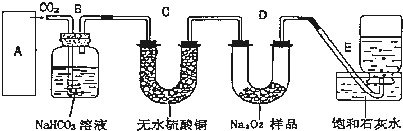
分析 (1)实验室用碳酸钙和稀盐酸反应制备二氧化碳,反应无需加热,采用固液不加热装置制备;实验中要依次进行除杂(除去挥发的HCl)、干燥收集等操作;
(2)E中的石灰水出现出现轻微白色浑浊,说明未反应的二氧化碳和澄清石灰水反应生成碳酸钙白色沉淀;
(3)根据过氧化钠的质量可以生成氧气的体积,理论生成气体的体积-实际氧气的体积=差值,结合反应不完全或者收集不全分析;
(4)根据D中的1.95g过氧化钠样品接近反应完毕时,进入E中的二氧化碳增多,生成氧气减少,是否能产生倒吸现象判断是否合理、安全;
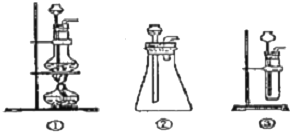
解答 解:(1)该反应的药品是固体和液体,且不需加热,所以所需装置为固液混合不加热型,所以排除①,故选②、③;
大理石和盐酸的反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢气体、水蒸气,氯化氢和碳酸氢钠能反应生成二氧化碳,所以B装置的作用是吸收A装置中产生的盐酸酸雾,除去HCl气体;
二氧化碳和无水硫酸铜不反应,水蒸气能使无水硫酸铜由白色变蓝色,所以C装置内可能出现的现象是白色固体变蓝色;
过氧化钠和二氧化碳反应生成氧气,氧气能使带火星的木条复燃,检验时,可用带火星的木条放在管口,木条复燃说明收集到的气体为氧气,
故答案为:②、③;吸收A装置中产生的盐酸酸雾;白色固体变蓝色;用带火星的木条放在管口,木条复燃说明收集到的气体为氧气;
(2)二氧化碳能使澄清的石灰水变浑浊,若E中石灰水出现轻微白色浑浊,说明未反应的二氧化碳与石灰水反应生成碳酸钙白色沉淀,离子方程式为:Ca2++2OH-+CO2═CaCO3↓+H2O;
故答案为:Ca2++2OH-+CO2═CaCO3↓+H2O;
(3)1.95g过氧化钠完全反应生成氧气的体积为v.
2Na2O2+2CO2═2Na2CO3+O2;
2mol 22.4L
$\frac{1.95g}{78g/mol}$=0.025mol V
V=$\frac{0.025×22.4}{2}$L=0.28L=280mL>260mL,所以实际收集到的氧气体积比理论计算值小,280mL-260mL=20mL;
原因是Na2O2 没有反应完全或者D装置可能有氧气未被排出;
故答案为:小;30;Na2O2可能含有不与二氧化碳反应的其它杂质,D装置可能有氧气未被排出;
(4)E装置饱和石灰水能和二氧化碳反应,所以饱和石灰水的作用是吸收二氧化碳,收集较纯净的氧气,当D中的1.95g过氧化钠样品接近反应完毕时,进入E中的二氧化碳增多,生成氧气减少,压强变小,所以E中可能会因二氧化碳与石灰水反应而倒吸,不安全、不合理;
故答案为:否;E装置没有防倒吸装置,容易引起倒吸.
点评 本题以钠的化合物为载体综合考查学生的分析能力和实验能力,为高频考点,注意把握实验的原理和注意事项,结合物质的性质把握实验,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | B. | BaCl2 Na2SO4 (NH4)SO4 KOH | ||
| C. | AgNO3 NaCl KCl CuCl2 | D. | Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+) | |
| B. | c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L | |
| C. | c(C2O42-)<c(HC2O4-)<c(H2C2O4) | |
| D. | c(C2O42-)+c(HC2O4-)+c(H2C2O4)<c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
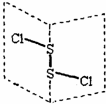 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )| A. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| B. | 反应中SO2是氧化产物,S是还原产物 | |
| C. | S2Cl2的分子构型与H2O2的分子构型相似 | |
| D. | 反应中,生成3molS,转移电子数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com