
分析 (1)红褐色液相分散系是Fe(OH)3胶体,则A是FeCl3,FeCl3饱和溶液在加热条件下水解生成氢氧化铁胶体,HCl具有挥发性,加热促进HCl挥发,从而促进FeCl3水解,蒸干时得到固体Fe(OH)3,灼烧Fe(OH)3得到Fe2O3;
(2)地壳中含量最高的金属元素是Al,则B为AlCl3,反应生成白色沉淀为Al(OH)3,其物质的量为0.1mol,小于氯化铝的物质的量0.05L×6mol/L=0.3mol,若碱不足,只发生Al3++3OH-═Al(OH)3↓,也可能Al原子转化为Al(OH)3↓、KAlO2,发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,结合方程式计算;
(3)Al-Fe-KOH溶液原电池,其中Al为负极,Fe为正极,负极Al失去电子,碱性条件下生成偏铝酸钠与水;
(4)Pt元素由0价升高为+4价,化合价升高4价,N元素由+5价降低为+2价,化合价降低3价,化合价升降最小公倍数为12,则Pt的系数为3,HNO3的系数为4,再结合原子守恒配平.
解答 解:(1)红褐色液相分散系是Fe(OH)3胶体,则A的饱和溶液是氯化铁饱和溶液,FeCl3饱和溶液在加热条件下水解生成氢氧化铁胶体,化学方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,HCl具有挥发性,加热促进HCl挥发,从而促进FeCl3水解,蒸干时得到固体Fe(OH)3,灼烧Fe(OH)3得到Fe2O3,化学方程式为反应方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,所以最终得到的固体是Fe2O3,
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;Fe2O3;
(2)地壳中含量最高的金属元素是Al,则B为AlCl3,
沉淀的质量是7.8g,其物质的量为$\frac{7.8g}{78g/mol}$=0.1mol,小于氯化铝的物质的量0.05L×6mol/L=0.3mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,KOH的物质的量为0.1mol×3=0.3mol,其物质的量浓度为$\frac{0.3mol}{0.1L}$=3mol/L;
②Al元素转化为Al(OH)3↓、KAlO2,则:
Al3++3OH-═Al(OH)3↓
0.3mol 0.9mol 0.3mol
Al(OH)3+OH-═AlO2-+2H2O
(0.3-0.1)mol 0.2mol
则消耗的碱的物质的量为0.9mol+0.2mol=1.1mol,其物质的量浓度为$\frac{1.1mol}{0.1L}$=11mol/L;
故答案为:3mol/L或11mol/L;
(3)Al-Fe-KOH溶液原电池,Al和氢氧化钠溶液能发生反应,Fe和氢氧化钠溶液不反应,因此Al为负极,Fe为正极,负极电极反应式为:Al-3e-+4OH-=AlO2-+2H2O,
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(4)Pt元素由0价升高为+4价,化合价升高4价,N元素由+5价降低为+2价,化合价降低3价,化合价升降最小公倍数为12,则Pt的系数为3,HNO3的系数为4,结合原子守恒配平:3Pt+4HNO3+18HCl=3H2PtCl6+4NO+8H2O,
故答案为:3、4、18、3、4、8H2O.
点评 本题比较综合,涉及无机物推断、化学计算、原电池、氧化还原反应配平等,属于拼合型题目,需要学生具备扎实的基础,难度中等.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O含有3NA个原子 | |
| B. | 1 mol甲苯含有6NA个C-H键 | |
| C. | 标准状况下,22.4 L氯水含有NA个Cl2分子 | |
| D. | 2.8 g乙烯和丁烯的混合气体中所含原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
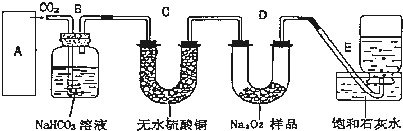
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数是6 | B. | 质量数是14 | C. | 电子数是14 | D. | 中子数是14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体 | |
| B. | 钠与乙醇反应比与水反应要剧烈得多 | |
| C. | 除去苯中的苯酚可采用加入足量的NaOH溶液后分液的方法 | |
| D. | 除去硫酸铝溶液中混有的硫酸镁,可加入足量烧碱,过滤,向滤液中加入适量硫酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
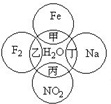 如图所示两圆圈相交的部分表示圆圈内物质间相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )
如图所示两圆圈相交的部分表示圆圈内物质间相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )| A. | 甲 | B. | 乙 | C. | 丙 | D. | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电解生成氢气和氧气,说明水中含有氢分子和氧分子 | |
| B. | 用肥皂水不可以区分硬水和软水 | |
| C. | 将黄河水经沉降、过滤、吸附,灭菌等净化操作后,可供人们生活用水 | |
| D. | 水体有一定的自净功能,部分工业污水可直接排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )
如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )| A. | 4:17 | B. | 3:7 | C. | 8:13 | D. | 7:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com