
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础。
实验室欲分离乙酸(沸点为118℃)和乙醇(沸点为78℃)的混合物,请按要求作答。
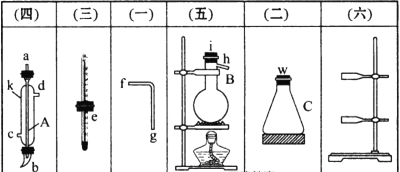
(1)图中A、B两种仪器的名称是________、________。
(2)A仪器中进水口是________(填“c”或“d”)。
(3)分离混合物时,温度计的________应处于______________。
(4)在B中注入混合物后,加入几片碎瓷片的目的是___________________________。
科目:高中化学 来源: 题型:
【题目】山萘酚(Kaempf erol)结构如下图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用。下列有关山萘酚的叙述正确的是 ( )
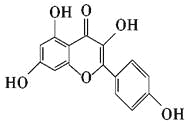
A. 结构式中含有羟基、醚键、酯基、碳碳双键
B. 可发生取代反应、水解反应、加成反应
C. 可与NaOH反应,不能与NaHCO3反应
D. 1 mol山萘酚与溴水反应最多可消耗4 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列离子或物质的氧化性强弱顺序为:ClO3->BrO3->Cl2>IO3-,试回答下列问题:
(1)反应:Cl2+I2+H2O→HCl+HIO3能否发生?_____(填“能”或“不能”)。若能,请配平_______________。若不能,请说明理由____。
(2)已知反应:PbO2+4HCl(浓)= PbCl2+Cl2↑+2H2O,浓HCl的作用是__,二者个数之比为__,若生成标况下氯气28L,转移电子个数为____,请将其改写为离子方程式____。
(3)用双线桥表示下面的反应:(得失电子数、化合价变化情况、被氧化/被还原)___________
3MnO2+KClO2+6KOH=3K2MnO4+KCl+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,半径最大的是( )
A. 1s22s22p63s23p5 B. 1s22s22p3
C. 1s22s22p2 D. 1s22s22p63s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中正确的是( )
A. KClO3在反应中是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 在反应中H2C2O4既不是氧化剂也不是还原剂
D. 1 mol KClO3参加反应有1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( )
A. 将CH3COONa溶液从20℃升温至30℃,溶液中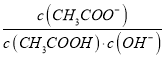 增大
增大
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol/L HCOOH 与 0.1 mol/L NaOH 等体积混合后:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol/L CH3COONa 与 0.1 mol/L盐酸等体积混合后 (pH<7):c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
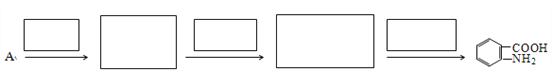
【题目】抗结肠炎药物有效成分M的合成路线如下(部分反应略去试剂和条件):
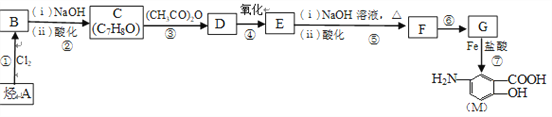
已知:
(1)烃A的结构简式是__________,G中的官能团名称是__________。
(2)反应①的反应条件是_________,反应⑥的反应类型是__________。
(3)下列对抗结肠炎药物有效成分M可能具有的性质推测正确的是________(填字母)。
A.既有酸性又有碱性 B.能发生消去反应
C.能发生加聚反应 D.1mol M与足量溴水充分反应,最多消耗1molBr2
(4)E与足量NaOH溶液反应的化学方程式是_______________________。
(5)写出符合下列条件的D的同分异构体的结构简式(任写一种)__________。
①属于芳香族化合物且苯环上有3个取代基
②能和NaHCO3溶液反应产生气体
③核磁共振氢谱有4组峰且峰面积之比为6∶2∶1∶1
(6)M在一定条件下可以发生缩聚反应生成含肽键的高分子化合物,写出该反应的化学方程式:_______________________________________________________
(7)已知:①![]() 易被氧化,②苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位。③苯环上连有羧基时再引入一个取代基,常取代在羧基的间位。参照以上的合成路线,设计一条以A为原料合成化合物
易被氧化,②苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位。③苯环上连有羧基时再引入一个取代基,常取代在羧基的间位。参照以上的合成路线,设计一条以A为原料合成化合物![]() 的合成路线。_______
的合成路线。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年,中科院大连化学物理研究所碳资源小分子与氢能利用创新特区研究组(DNL19T3)孙剑、葛庆杰研究员团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油。该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1) 工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5~26.5℃后用氨水吸收过量的CO2,该反应的化学方程式为_____________。在用氨水吸收前,烟气需冷却至15.5~26.5℃的可能原因是_________________。
(2) 该研究成果用CO2制取高辛烷值汽油的路线是先将CO2按逆水煤气反应生成CO,然后由CO与H2反应生成烃,产物中汽油组分占所有烃类产物的百分比近80%。
① 已知:H2 (g)+![]() O2 (g) === H2O(l) ΔH1= —285.8 kJ·mol-1
O2 (g) === H2O(l) ΔH1= —285.8 kJ·mol-1
C8H18(l)+![]() O2(g) === 8CO2(g)+9H2O(l) ΔH3= —5518 kJ·mol-1
O2(g) === 8CO2(g)+9H2O(l) ΔH3= —5518 kJ·mol-1
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方
程式__________________________。
② 在一实验容器中充入一定量的CO2和H2,若加入催化剂恰好完全反应,且产物只生成C5以上的烃类物质和水,则CO2与H2的物质的量之比不低于________。
(3) 二甲醚(CH3OCH3)的十六烷值高,燃烧尾气中污染物少,可代替柴油。CO、CO2混合加氢的方法是在一个反应器中将合成气直接转化为二甲醚,包括以下4个反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ①
CH3OH(g)+H2O(g) ①
CO2(g)+H2(g)![]() CO(g)+H2O(g) ②
CO(g)+H2O(g) ②
CO(g)+2H2(g)![]() CH3OH(g) ③
CH3OH(g) ③
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ④
CH3OCH3(g)+H2O(g) ④
① 已知反应④在某温度下的平衡常数为K=400。此温度下,在一恒容密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
此时正、逆反应速率的大小:v(正) ______ v(逆) (填“>”、“<”或“=”)。
若加入CH3OH后,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=_____。
② 某科研小组在反应温度503K~543K,反应压强分别是3、4、5、6、7MPa,n(CO)/n(CO+CO2)=0.5的情况下计算了二甲醚的平衡收率(二甲醚实际产量与反应物总量之比),结果如图1所示。

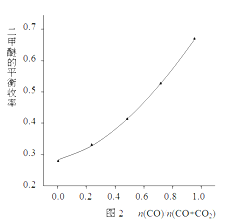
a~e曲线分别对应不同的压强条件,则e对应的压强是______,理由是___________。
该科研小组在反应温度523K、反应压强5MPa的条件下,按照合成反应的化学计量比进料,改变n(CO)/n(CO+CO2)的比例,二甲醚的平衡收率的变化规律如图2所示。
由图2可知,二甲醚的平衡收率随着n(CO)/n(O+CO2)比值的增大而单调上升,其原因是________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com