
【题目】已知下列离子或物质的氧化性强弱顺序为:ClO3->BrO3->Cl2>IO3-,试回答下列问题:
(1)反应:Cl2+I2+H2O→HCl+HIO3能否发生?_____(填“能”或“不能”)。若能,请配平_______________。若不能,请说明理由____。
(2)已知反应:PbO2+4HCl(浓)= PbCl2+Cl2↑+2H2O,浓HCl的作用是__,二者个数之比为__,若生成标况下氯气28L,转移电子个数为____,请将其改写为离子方程式____。
(3)用双线桥表示下面的反应:(得失电子数、化合价变化情况、被氧化/被还原)___________
3MnO2+KClO2+6KOH=3K2MnO4+KCl+3H2O
【答案】能 5Cl2+I2+6H2O===10HCl+2HIO3 酸性、还原性 1:1 2.5NA PbO2+4H++2Cl-(浓)===Pb2++Cl2↑+2H2O 
【解析】
(1)在氧化还原反应中,氧化剂的氧化性大于氧化产物,由已知氧化性强弱顺序为: Cl2>IO3-,所以反应Cl2+I2+H2O→HCl+HIO3能发生;反应中氯元素化合价由0价降为-1价,碘元素化合价由0价升为+5价,根据氧化还原反应得失电子守恒,所以Cl2和I2 的计量系数之比为5:1,然后根据氧原子质量守恒配平水的计量系数,故配平的化学方程式为:5Cl2+I2+6H2O=10HCl+2HIO3;
(2) 反应PbO2+4HCl(浓)===PbCl2+Cl2↑+2H2O中,4个HCl,其中2个HCl中氯元素化合价由-1价升为0价,失去电子,被氧化,作还原剂;其中2个HCl与Pb2+结合为PbCl2,表现为酸性;显还原性和酸性的HCl个数之比为1:1;由反应方程式可知,生成1mol氯气转移2mol电子,标况下28L氯气的物质的量为28L÷22.4L/mol=1.25mol,所以转移的电子的物质的量为1.25mol×2=2.5mol,故转移电子数为2.5NA;反应中PbO2为氧化物,Cl2为单质, H2O为弱电解质,在离子方程式中不能拆,故离子反应方程式为PbO2+4H++2Cl-(浓)=Pb2++Cl2↑+2H2O;
(3)反应3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O中锰元素化合物由+4价升为+6价,失去电子,氯元素由+5价降为-1价,得到电子,所以双线桥可表示为:
3K2MnO4+KCl+3H2O中锰元素化合物由+4价升为+6价,失去电子,氯元素由+5价降为-1价,得到电子,所以双线桥可表示为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+.为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案.

(1)A、B、D分别为_______、______、____________。
(2)操作Ⅱ、操作Ⅲ分别是_____________、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g) + O2(g) ![]() 2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )
2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )
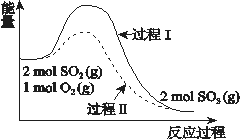
A. 2SO2(g) + O2(g) ![]() 2SO3(l) ΔH > a kJ/mol
2SO3(l) ΔH > a kJ/mol
B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将2molSO2(g) 和1mol O2(g)置于一密闭容器中充分反应后放出或吸收的热量小于┃a┃ kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)B的轨道排布式是_____________________________________,A、B、C、D的第一电离能由小到大的顺序为___________________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础。
实验室欲分离乙酸(沸点为118℃)和乙醇(沸点为78℃)的混合物,请按要求作答。
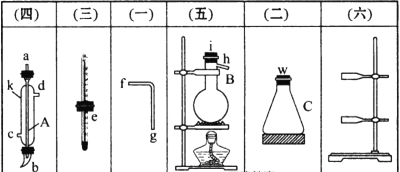
(1)图中A、B两种仪器的名称是________、________。
(2)A仪器中进水口是________(填“c”或“d”)。
(3)分离混合物时,温度计的________应处于______________。
(4)在B中注入混合物后,加入几片碎瓷片的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中常用的某种香料X的结构简式为: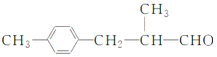
已知:
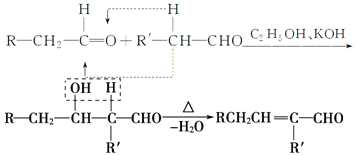
香料X的合成路线如下:
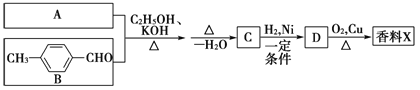
(1)A的结构简式是________________。
(2)检验有机物C中含有碳碳双键所需用的试剂_____________。
a.银氨溶液 b.酸性高锰酸钾溶液
c.溴水 d.氢氧化钠溶液
(3)D→X的化学方程式为____________________________。
(4)有机物B的某种同分异构体E,具有如下性质:
a.与浓溴水反应生成白色沉淀,且1 mol E最多能与4 mol Br2反应
b.红外光谱显示该有机物中存在碳碳双键
则E的结构简式为________________。
(5)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由丙烯[CH3CH=CH2]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由丙烯[CH3CH=CH2]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)____________________。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com