
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)B的轨道排布式是_____________________________________,A、B、C、D的第一电离能由小到大的顺序为___________________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。

【答案】 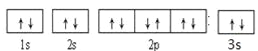 A1<Mg<S<N MgCl2为离子晶体而A1C13为分子晶体 sp2 V形 Cu3N
A1<Mg<S<N MgCl2为离子晶体而A1C13为分子晶体 sp2 V形 Cu3N ![]()
【解析】C元素是地壳中含量最高的金属元素,所以C是Al元素,D原予核外的M层中有两对成对电子,且D的原子序数大于C,所以D是S元素,E原子核外最外层只有1个电子,其余各层电子均充满,且E是前四周期的元素,E的原子序数大于16,所以E是Cu元素,A原子核外有三个未成对电子,且原子序数小于13,所以A是N元素,A与B可形成离子化合物B3A2,且B的原子序数大于A小于C,所以B是Mg元素.
(1)B是Mg元素,核电荷数为12,根据核外电子排布规律B的轨道排布式是![]() ,Mg、Al、S元素是同一周期元素,同一周期元素的第一电离能逐渐增大,但镁的第一电离能大于铝的第一电离能,同一主族的第一电离能随着原子序数的增大而减小,所以N元素的第一电离能大于P元素,P元素第一电离能大于S元素,所以Mg、Al、S、N元素的第一电离能由小到大的顺序为Al<Mg<S<N。故答案为:
,Mg、Al、S元素是同一周期元素,同一周期元素的第一电离能逐渐增大,但镁的第一电离能大于铝的第一电离能,同一主族的第一电离能随着原子序数的增大而减小,所以N元素的第一电离能大于P元素,P元素第一电离能大于S元素,所以Mg、Al、S、N元素的第一电离能由小到大的顺序为Al<Mg<S<N。故答案为:  、 A1<Mg<S<N
、 A1<Mg<S<N
(2)氯化镁是离子晶体,氯化铝是分子晶体,所以离子晶体的熔点远大于分子晶体的熔点,故答案为:MgCl2为离子晶体而A1C13为分子晶体
(3)A的最高价含氧酸根离子是NO3-,NO3-中,中心N原子价层电子对=3+![]() =3,所以N原子采取sp2杂化,D的低价氧化物是SO2,SO2的价层电子对=2+
=3,所以N原子采取sp2杂化,D的低价氧化物是SO2,SO2的价层电子对=2+![]() =3,含有一个孤电子对,所以分子空间构型是V形,故答案为:sp2、V形
=3,含有一个孤电子对,所以分子空间构型是V形,故答案为:sp2、V形
(4)该晶胞中白色球个数=![]() =1,黑色小球个数=12×
=1,黑色小球个数=12×![]() =3,N元素形成的负价是-3价,所以该晶胞中含有3个亚铜离子1个N离子,所以其化学式为Cu3N;
=3,N元素形成的负价是-3价,所以该晶胞中含有3个亚铜离子1个N离子,所以其化学式为Cu3N;![]() =
=![]() =
=![]() 故答案为:Cu3N、
故答案为:Cu3N、![]()


科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):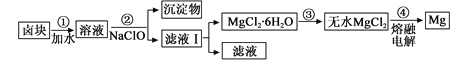
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程属非自发的是
A. NaOH溶于水形成溶液 B. 水电解生成H2和O2
C. 气体从高密度处向低密度处扩散 D. 一瓶N2和一瓶H2混合后,形成均匀的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A常用于食品行业。已知4.5 g A在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重2.7 g和6.6 g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量为___,则A的分子式是____。

(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是________。
(3) A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是______。
(4)0.05 mol A与足量Na反应,在标准状况下产生H2的体积是________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列离子或物质的氧化性强弱顺序为:ClO3->BrO3->Cl2>IO3-,试回答下列问题:
(1)反应:Cl2+I2+H2O→HCl+HIO3能否发生?_____(填“能”或“不能”)。若能,请配平_______________。若不能,请说明理由____。
(2)已知反应:PbO2+4HCl(浓)= PbCl2+Cl2↑+2H2O,浓HCl的作用是__,二者个数之比为__,若生成标况下氯气28L,转移电子个数为____,请将其改写为离子方程式____。
(3)用双线桥表示下面的反应:(得失电子数、化合价变化情况、被氧化/被还原)___________
3MnO2+KClO2+6KOH=3K2MnO4+KCl+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.含有共价键的化合物一定是共价化合物
B.非金属元素之间不可能形成离子化合物
C.气体分子间一定存在分子间作用力,但分子内不一定含共价键
D.两种不同的非金属元素形成的化合物只存在极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中正确的是( )
A. KClO3在反应中是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 在反应中H2C2O4既不是氧化剂也不是还原剂
D. 1 mol KClO3参加反应有1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行相应的实验(部分夹持装置略去),不能达到实验目的的是
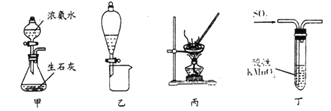
A. 利用图甲装置可快速制取少量氨气
B. 利用图乙装置分离水和溴的苯溶液
C. 利用图丙装置蒸发KCl溶液得晶体
D. 图丁装置中溶液颜色变浅,说明SO2具有漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com