
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):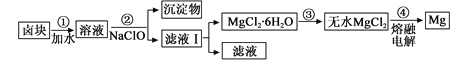
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。
【答案】(1)2Cl-+2H2O![]() Cl2 ↑+H2↑+ 2OH-
Cl2 ↑+H2↑+ 2OH-
(2)3Br2+ 3Na2CO3![]() NaBrO3+ 5NaBr +3CO2
NaBrO3+ 5NaBr +3CO2
(3)①除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去
②ClO-+2Fe2+ +5H2O=2Fe(OH)3+ Cl-+4H+;
③Mg2+ +2H2O![]() Mg(OH)2+2H+,温度升高,水解程度增大,通入 HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解。HCl还能带出水份,最终得到无水MgCl2;
Mg(OH)2+2H+,温度升高,水解程度增大,通入 HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解。HCl还能带出水份,最终得到无水MgCl2;
④22.35
【解析】试题分析:(1)制备烧碱,常电解饱和食盐水,因此离子反应方程式为:2Cl—+2H2O![]() Cl2 ↑+H2↑+ 2OH—;(2)Br2在此反应中既做氧化剂又做还原剂,Br2→NaBrO3,化合价升高5价,必然有化合价降低,Br2→NaBr化合价降低1价,最小公倍数为5,因此反应方程式为3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2;(3)①根据生成氢氧化物沉淀的pH,当pH=9.8时,Fe3+、Fe2+、Mn2+全部转化成沉淀,因此目的是:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;②ClO-→Cl-化合价降低2价,Fe2+→Fe(OH)3化合价升高1价,最小公倍数2,因此离子反应方程式为ClO-+2Fe2++5H2O=Cl-+2Fe(OH)3↓+4H+;③Mg2+ +2H2O
Cl2 ↑+H2↑+ 2OH—;(2)Br2在此反应中既做氧化剂又做还原剂,Br2→NaBrO3,化合价升高5价,必然有化合价降低,Br2→NaBr化合价降低1价,最小公倍数为5,因此反应方程式为3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2;(3)①根据生成氢氧化物沉淀的pH,当pH=9.8时,Fe3+、Fe2+、Mn2+全部转化成沉淀,因此目的是:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;②ClO-→Cl-化合价降低2价,Fe2+→Fe(OH)3化合价升高1价,最小公倍数2,因此离子反应方程式为ClO-+2Fe2++5H2O=Cl-+2Fe(OH)3↓+4H+;③Mg2+ +2H2O![]() Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解 ,HCl还能带出水份,最终得到无水MgCl2 ;③根据信息,NaClO和CO(NH2)反应生成NaCl、N2和CO2,尿素中N被氧化成N2,其他元素化合价不变,根据得失电子数目守恒,0.1×2×3=m(NaClO)×2/74.5,m(NaClO)=22.35g。
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解 ,HCl还能带出水份,最终得到无水MgCl2 ;③根据信息,NaClO和CO(NH2)反应生成NaCl、N2和CO2,尿素中N被氧化成N2,其他元素化合价不变,根据得失电子数目守恒,0.1×2×3=m(NaClO)×2/74.5,m(NaClO)=22.35g。


科目:高中化学 来源: 题型:
【题目】某同学利用如下实验装置制备少量的漂白粉。回答下列问题:
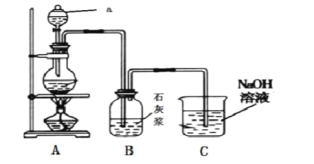
(1)漂白粉的有效成分是__________________(填化学式)。
(2)仪器a的名称是____________,用二氧化锰和浓盐酸制取氯气的化学方程式为MnO2 + 4HCl (浓)![]() MnCl2 + Cl2 ↑+ 2H2O 该反应中氧化剂与还原剂的物质的量之比为 ________________。
MnCl2 + Cl2 ↑+ 2H2O 该反应中氧化剂与还原剂的物质的量之比为 ________________。
(3)装置B发生反应的化学方程式为___________________________________。
(4)装置C的作用是___________,C中发生反应的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作电极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
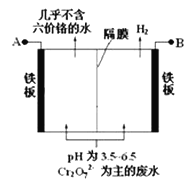
A. A为电源正极
B. 阴极区电极反应可能有:Cr2O72- + 6e- + 14H+ = 2Cr3++7H2O
C. 阳极区溶液中发生的氧化还原反应为:Cr2O72- +6Fe2+ +14H+ == 2Cr3+ +6Fe3+ + 7H2O
D. 若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,装置中有0.1 mol Cr2O72-被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质,D为正盐。

请回答下列问题:
(1)写出各物质的名称:
A_____________ ; C_____________;D_____________。
(2)写出相应的离子方程式:
B→C: _____________________________;
C→D: ______________________________;
A→C: _____________________________;
D→E:_____________________________(任写一个即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)下面曲线表示卤族元素某种性质随核电荷数的变化趋势。正确的是_______。

(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为_______。
(3)F2与其他卤素单质反应可以生成CF3、BrF3等。已知反应Cl2(g)+3F2(g)=2C1F3(g)△H=-313kJ/mo1;F-F键的键能为159 kJ/mo1;,Cl-C1键的键能为242 kJ/mo1;则ClF3中C1-F键的平均健能为____kJ/mol。ClF3的熔、沸点比BrF3的______(填“高”或“低”)。
(4)根据第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(5)无机含氧酸HmROn可以写成(HO)mROn-m的形式,(n-m)的值越大,HmROn的酸性越强。则酸性:H2SeO4_____H2SeO3(填“<”或“>”)。
(6)S的常见单质S8的结构为![]() ,S原子的轨道杂化方式是______。
,S原子的轨道杂化方式是______。
(7)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体。CH4与H2O形成的水合物俗称“可燃冰”。“可燃冰“中存在的分子间作用力是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷、乙烯、乙炔共同具有的性质是( )
A.都能发生聚合反应生成高分子化合物B.能够使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内D.都难溶于水,且密度比水小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)B的轨道排布式是_____________________________________,A、B、C、D的第一电离能由小到大的顺序为___________________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com