
【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)下面曲线表示卤族元素某种性质随核电荷数的变化趋势。正确的是_______。

(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为_______。
(3)F2与其他卤素单质反应可以生成CF3、BrF3等。已知反应Cl2(g)+3F2(g)=2C1F3(g)△H=-313kJ/mo1;F-F键的键能为159 kJ/mo1;,Cl-C1键的键能为242 kJ/mo1;则ClF3中C1-F键的平均健能为____kJ/mol。ClF3的熔、沸点比BrF3的______(填“高”或“低”)。
(4)根据第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(5)无机含氧酸HmROn可以写成(HO)mROn-m的形式,(n-m)的值越大,HmROn的酸性越强。则酸性:H2SeO4_____H2SeO3(填“<”或“>”)。
(6)S的常见单质S8的结构为![]() ,S原子的轨道杂化方式是______。
,S原子的轨道杂化方式是______。
(7)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体。CH4与H2O形成的水合物俗称“可燃冰”。“可燃冰“中存在的分子间作用力是_______。

【答案】 a ![]() 172 低 碘 > sp3 氢键、范德华力
172 低 碘 > sp3 氢键、范德华力
【解析】(1)考查同主族性质的递变性,a、同主族从上到下电负性逐渐降低,故a正确;b、F非金属性很强,没有正价,故b错误;c、HF分子间存在氢键,因此HF的沸点最高,故c错误;d、卤族元素单质从上到下,状态从气体、液体、固体变化,熔沸点逐渐升高,故d错误;(2)考查电子式的书写,溴化碘与水反应:IBr+H2O=HIO+HBr,HIO的电子式类似于HClO的电子式,即HIO的电子式为![]() ;(3)考查焓变与键能的关系,物质熔沸点高低的判断,令Cl-F键能为xkJ·mol-1,△H=反应物键能总和-生成物键能总和=(242+3×159-6×x)=-313kJ·mol-1,解得x=172,结构相似,BrF3的相对分子量大于ClF3的相对分子质量,因此BrF3的范德华力大于ClF3,即BrF3熔沸点高于ClF3;(4)考查第一电离能,根据表格数据,碘的第一电离能最小,容易失去电子,因此生成较稳定的单核阳离子的卤素原子是碘;(5)考查含氧酸酸性强弱比较,H2SeO4可以写成(HO)2SeO2,H2SeO3可以写成(HO)2SeO,根据信息,推出H2SeO4的酸性强于H2SeO3;(6)根据结构,S有2个σ键,2个孤电子对,即价层电子对数为4,S的杂化类型为sp3;(7)根据结构,含有分子间作用力是范德华力和氢键。
;(3)考查焓变与键能的关系,物质熔沸点高低的判断,令Cl-F键能为xkJ·mol-1,△H=反应物键能总和-生成物键能总和=(242+3×159-6×x)=-313kJ·mol-1,解得x=172,结构相似,BrF3的相对分子量大于ClF3的相对分子质量,因此BrF3的范德华力大于ClF3,即BrF3熔沸点高于ClF3;(4)考查第一电离能,根据表格数据,碘的第一电离能最小,容易失去电子,因此生成较稳定的单核阳离子的卤素原子是碘;(5)考查含氧酸酸性强弱比较,H2SeO4可以写成(HO)2SeO2,H2SeO3可以写成(HO)2SeO,根据信息,推出H2SeO4的酸性强于H2SeO3;(6)根据结构,S有2个σ键,2个孤电子对,即价层电子对数为4,S的杂化类型为sp3;(7)根据结构,含有分子间作用力是范德华力和氢键。


科目:高中化学 来源: 题型:
【题目】巴豆酸的结构简式为CH3—CH=CH—COOH,现有①水 ②氯化氢 ③乙醇 ④纯碱溶液 ⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是
A.只有②④⑤B.只有①③④C.只有①②④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属吸热反应的是( )
A.镁与盐酸反应放出氢气
B.氢氧化钠与盐酸的反应
C.硫在空气或氧气中燃烧
D.Ba(OH)28H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):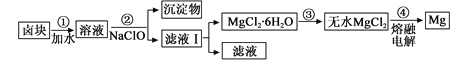
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是
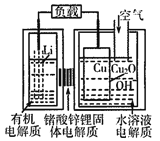
A. 该电池负极不能用水溶液作为电解质
B. 放电时,Li+透过固体电解质向Cu极移动
C. 通空气时铜被腐蚀,表面产生Cu2O
D. 放电时,正极的电极反应式为:O2+2H2O+4e-═4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异成二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe2+的核外电子排布式__________。
(2)下列说法正确的是_______。
a.H2S和O3分子的构型相同
b.BF3和NH3分子的极性相同
c.CO2、HCN分子中C原子的杂化方式相同
d.CH3COOH分子中C原子的杂化方式相同
(3)N3-与CO2分子互为等电子体,则N3-的空间构型为_______。含Co3+的配合物Co[(N3)(NH3)5]SO4中的配体是_________。
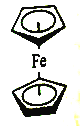
(4)二茂铁是由C5H5-和Fe2+形成的配合物,其结构如图所示。该配合物中共含有____种化学环境不同的氢。
(5)砷和氮位于同一主族,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,它们有着广泛的用途。同答下列问题:
①写出砷的价电子排布式___________。
②工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出该反应的化学方程式: ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程属非自发的是
A. NaOH溶于水形成溶液 B. 水电解生成H2和O2
C. 气体从高密度处向低密度处扩散 D. 一瓶N2和一瓶H2混合后,形成均匀的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中正确的是( )
A. KClO3在反应中是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 在反应中H2C2O4既不是氧化剂也不是还原剂
D. 1 mol KClO3参加反应有1 mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com