
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是
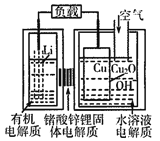
A. 该电池负极不能用水溶液作为电解质
B. 放电时,Li+透过固体电解质向Cu极移动
C. 通空气时铜被腐蚀,表面产生Cu2O
D. 放电时,正极的电极反应式为:O2+2H2O+4e-═4OH-
【答案】D
【解析】根据放电过程的反应方程式2Li+Cu2O+H2O=2Cu+2Li++2OH-知,反应中Li元素化合价由0价变为+1价、Cu元素化合价由+1价变为0价,所以负极上电极反应式为Li-e-=Li+、正极反应式为 Cu2O+H2O+2e-=2Cu+2OH-。A. 该电池的负极为锂,是活泼的金属,能够与水反应,不能用水溶液作为电解质,故A正确;B.放电时,阳离子向正极移动,则Li+透过固体电解质向Cu极移动,故B正确; C.放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,可知通空气时,铜被腐蚀,表面产生Cu2O,故C正确;D.根据电池反应式知,正极反应式为 Cu2O+H2O+2e-=2Cu+2OH-,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】将牛奶和姜汁混合,待牛奶凝固便成为一种富有广东特色的甜品——姜撞奶。为了掌握牛奶凝固所需的条件,某同学在不同温度的等量牛奶中混人一些新鲜姜汁,观察混合物15min,看其是否会凝固,结果如下表。请回答下列问题:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
结果 | 15min后仍未有凝固迹象 | 14min内完全凝固 | 1min内完全凝固 | 1min内完全凝固 | 15min后仍未有凝固迹象 |
(注:用曾煮沸的姜汁重复这项实验,牛奶在任何温度下均不能凝固)
(1)实验证明新鲜姜汁中含有一种酶,其作用是 。
(2)20℃和100℃时,15min后仍未有凝固迹象,说明酶的活性较低,其原因分别是 和 。
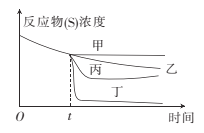
(3)若60℃时牛奶在有姜汁和没有姜汁的情况下都可以凝固,当反应进行到t时,向其中加人姜汁。下图中能正确表示加姜汁后牛奶凝固随时间变化趋势的曲线是 。
(4)为提高实验的准确度,实验中“不同温度的等量牛奶中混入一些新鲜姜汁”操作中应注意的是 。
(5)有同学说,该实验不能得出姜汁使牛奶凝固的最适温度,请提出解决方案: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作电极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
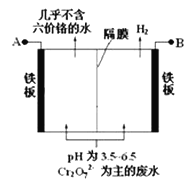
A. A为电源正极
B. 阴极区电极反应可能有:Cr2O72- + 6e- + 14H+ = 2Cr3++7H2O
C. 阳极区溶液中发生的氧化还原反应为:Cr2O72- +6Fe2+ +14H+ == 2Cr3+ +6Fe3+ + 7H2O
D. 若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,装置中有0.1 mol Cr2O72-被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质,D为正盐。

请回答下列问题:
(1)写出各物质的名称:
A_____________ ; C_____________;D_____________。
(2)写出相应的离子方程式:
B→C: _____________________________;
C→D: ______________________________;
A→C: _____________________________;
D→E:_____________________________(任写一个即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)下面曲线表示卤族元素某种性质随核电荷数的变化趋势。正确的是_______。

(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为_______。
(3)F2与其他卤素单质反应可以生成CF3、BrF3等。已知反应Cl2(g)+3F2(g)=2C1F3(g)△H=-313kJ/mo1;F-F键的键能为159 kJ/mo1;,Cl-C1键的键能为242 kJ/mo1;则ClF3中C1-F键的平均健能为____kJ/mol。ClF3的熔、沸点比BrF3的______(填“高”或“低”)。
(4)根据第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(5)无机含氧酸HmROn可以写成(HO)mROn-m的形式,(n-m)的值越大,HmROn的酸性越强。则酸性:H2SeO4_____H2SeO3(填“<”或“>”)。
(6)S的常见单质S8的结构为![]() ,S原子的轨道杂化方式是______。
,S原子的轨道杂化方式是______。
(7)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体。CH4与H2O形成的水合物俗称“可燃冰”。“可燃冰“中存在的分子间作用力是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前四周期的元素A、Z、Q、R、T的原子序数依次增大,且A、Z、Q同周期。A共有两个原子轨道上有电子,且电子数目相同。Z、Q相邻,且Z中的未成对电子数为3个,R元素在地壳中含量位于金属元素的第二位。T是人类最早使用的元素,并以这种元素命名了我国的一个时代。请回答下面的问题:
(1)A、Z、Q第一电离能从小到大的顺序为:_______________(填元素符号),T的价层电子排布图为:__________________________。
(2)Q的基态原子中能量最高的电子,其电子云在空间有___________个方向,原子轨道呈_______形。
(3)Z3-的立体构型为____________,写出与Z3-互为等电子体的一种非极性分子化学式____________。
(4)在不同的温度下,A以ACl2和二聚体A2Cl4两种形式存在,二聚体的结构式如图所示:
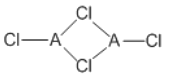
①ACl2中A的杂化方式为______________________。
②1mol A2Cl4中含配位键的数目为____________。
(5)R单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞的棱边长分别为acm、bcm,则R单质的体心立方晶胞和面心立方晶胞的密度之比为_________,R原子配位数之比为_____________。
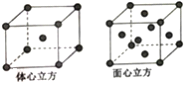
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷、乙烯、乙炔共同具有的性质是( )
A.都能发生聚合反应生成高分子化合物B.能够使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内D.都难溶于水,且密度比水小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是

A. 遇FeCl3溶液显紫色,因为该物质与苯酚互为同系物
B. 滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C. 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol
D. 该分子中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.凡是放热反应的发生均无需加热
B.凡是需要加热后才能发生的反应是吸热反应
C.伴有能量变化的物质变化都是化学变化
D.物质发生化学反应都伴随着能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com