
【题目】某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作电极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
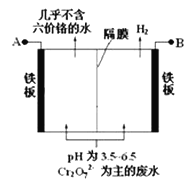
A. A为电源正极
B. 阴极区电极反应可能有:Cr2O72- + 6e- + 14H+ = 2Cr3++7H2O
C. 阳极区溶液中发生的氧化还原反应为:Cr2O72- +6Fe2+ +14H+ == 2Cr3+ +6Fe3+ + 7H2O
D. 若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,装置中有0.1 mol Cr2O72-被还原
【答案】D
【解析】A.由图可知,右侧生成氢气,发生还原反应,右侧铁板为阴极,故左侧铁板为阳极,故A为电源正极,选项A正确;B.阴极氢离子放电生成氢气,氢离子浓度降低,溶液的pH增大,选项B错误;C.左侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中的Cr2O72-氧化,反应生成Cr3+、Fe3+,反应的离子方程式为:Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ + 7H2O,选项C正确;D.13.44 L氢气的物质的量为![]() =0.6mol,根据电子转移守恒n(Fe2+)=
=0.6mol,根据电子转移守恒n(Fe2+)=![]() =0.6mol,根据Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ + 7H2O可知,被还原的Cr2O72-的物质的量为0.6mol×
=0.6mol,根据Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ + 7H2O可知,被还原的Cr2O72-的物质的量为0.6mol×![]() =0.1mol,选项D不正确。答案选D。
=0.1mol,选项D不正确。答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeS04[含A12(S04)3和少量重金属离子]可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:
①5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO4﹣+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(2)滤液经处理可得到副产品________,可作肥料。
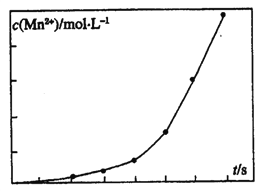
(3)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为_________。
(4)实验室测定高纯超微细草酸亚铁组成的步骤依次为
步骤1:准确称量一定量草酸亚铁样品,加入的H2S04溶解。
步骤2:用0.200 0molL-1标准KMn04溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2gZn粉和5mL2molL-1的H2S04溶液,将Fe3+还原为Fe2+
步骤4:过滤,滤液用上述标准KMn04溶液滴定,消耗溶液10.00 mL.
计算样品中C2O42-的物质的量_________________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,柠檬水溶液的pH是3,其中的c(OH-)是
A. 0.1 mol/L B. 1×10-3 mol/L C. 1×10-7 mol/L D. 1×10-11 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。
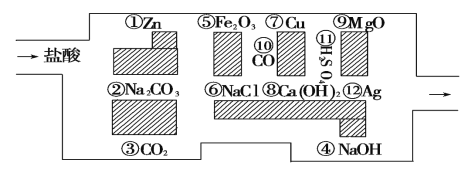
(1)请你帮助它走出迷宫(请用图中物质的序号先后连接起来表示所走的路线)_______________________ 。
(2)迷宫内12种物质中属于碱性氧化物的有 _____,写出其中一种与盐酸反应的离子方程式:_____。
(3)迷宫内 12 种物质中金属单质,按活动性顺序由强到弱是:_________,试写一个相互置换的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属吸热反应的是( )
A.镁与盐酸反应放出氢气
B.氢氧化钠与盐酸的反应
C.硫在空气或氧气中燃烧
D.Ba(OH)28H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】户外运动常带便餐自热饭,其“发热包”遇水即可发热,原理主要是将化学能转化为热能,“发热包”中可能含有下列物质中的( )
A. 氯化钠 B. 固体硝酸铵 C. 生石灰 D. 蔗糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):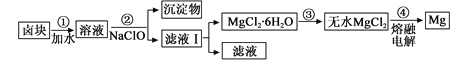
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是
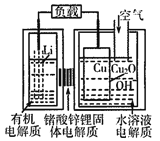
A. 该电池负极不能用水溶液作为电解质
B. 放电时,Li+透过固体电解质向Cu极移动
C. 通空气时铜被腐蚀,表面产生Cu2O
D. 放电时,正极的电极反应式为:O2+2H2O+4e-═4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A常用于食品行业。已知4.5 g A在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重2.7 g和6.6 g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量为___,则A的分子式是____。

(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是________。
(3) A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是______。
(4)0.05 mol A与足量Na反应,在标准状况下产生H2的体积是________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com