
【题目】户外运动常带便餐自热饭,其“发热包”遇水即可发热,原理主要是将化学能转化为热能,“发热包”中可能含有下列物质中的( )
A. 氯化钠 B. 固体硝酸铵 C. 生石灰 D. 蔗糖
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】室温时,体积为1mL、浓度均为0.1mol·L-1的两种常见物质X(OH)n、K2AO3的溶液分別加水稀释至体积为VmL,pH随lgV的变化情况如下图所示。下列叙述错误的是( )
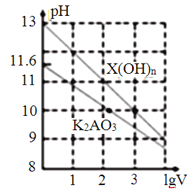
A. n=1
B. H2AO3的二级电离常数Ka2约为1.0×10-10.2
C. pH=10的两种溶液中水的电离程度相同
D. 升高温度,K2AO3溶液pH增大,X(OH)n溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离方法错误的是( )
A.除去混在植物油中的水——倾倒B.除去粗盐中的泥沙——过滤
C.用乙醚提取中草药中的有效成分——萃取D.除去氯气中的氯化氢气体——洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.5mol/L的硫酸溶液480mL,根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 ___________________________。
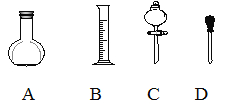
(2)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为__mL,如果实验室有15mL、20mL、50mL量筒,应选用______ mL量筒最好。
(3)在容量瓶的使用方法中,下列操作不正确的是____________。
A、使用容量瓶前检验是否漏水
B、容量瓶用水洗净后,再用待配溶液洗涤
C、配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1—2cm处,用胶头滴管加蒸馏水至刻度线。
D、配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.5mol/L(填“大于”“小于”或“等于”)。
(5)该同学在定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响__________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作电极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
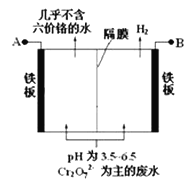
A. A为电源正极
B. 阴极区电极反应可能有:Cr2O72- + 6e- + 14H+ = 2Cr3++7H2O
C. 阳极区溶液中发生的氧化还原反应为:Cr2O72- +6Fe2+ +14H+ == 2Cr3+ +6Fe3+ + 7H2O
D. 若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,装置中有0.1 mol Cr2O72-被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(l)Y在元素周期表中的位置是__________;X氢化物的电子式是__________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈__________(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是__________。
(3)Y-AgO电池是应用广泛的鱼雷电池,其原理如下图所示。
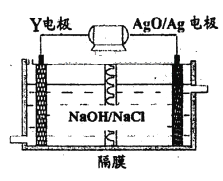
该电池的负极反应式是__________。
(4)Z和W比较,非金属性较弱的是__________(填元素符号),下列可以验证这一结论的是__________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1molH-Z或H-W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质,D为正盐。

请回答下列问题:
(1)写出各物质的名称:
A_____________ ; C_____________;D_____________。
(2)写出相应的离子方程式:
B→C: _____________________________;
C→D: ______________________________;
A→C: _____________________________;
D→E:_____________________________(任写一个即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前四周期的元素A、Z、Q、R、T的原子序数依次增大,且A、Z、Q同周期。A共有两个原子轨道上有电子,且电子数目相同。Z、Q相邻,且Z中的未成对电子数为3个,R元素在地壳中含量位于金属元素的第二位。T是人类最早使用的元素,并以这种元素命名了我国的一个时代。请回答下面的问题:
(1)A、Z、Q第一电离能从小到大的顺序为:_______________(填元素符号),T的价层电子排布图为:__________________________。
(2)Q的基态原子中能量最高的电子,其电子云在空间有___________个方向,原子轨道呈_______形。
(3)Z3-的立体构型为____________,写出与Z3-互为等电子体的一种非极性分子化学式____________。
(4)在不同的温度下,A以ACl2和二聚体A2Cl4两种形式存在,二聚体的结构式如图所示:
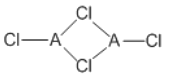
①ACl2中A的杂化方式为______________________。
②1mol A2Cl4中含配位键的数目为____________。
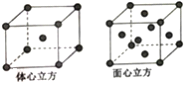
(5)R单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞的棱边长分别为acm、bcm,则R单质的体心立方晶胞和面心立方晶胞的密度之比为_________,R原子配位数之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氧化反应一定有氧气的参与B.得到电子,发生了还原反应
C.置换反应不一定是氧化还原反应D.所含元素化合价升高的物质被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com