
【题目】下列说法正确的是( )
A.氧化反应一定有氧气的参与B.得到电子,发生了还原反应
C.置换反应不一定是氧化还原反应D.所含元素化合价升高的物质被还原
科目:高中化学 来源: 题型:
【题目】户外运动常带便餐自热饭,其“发热包”遇水即可发热,原理主要是将化学能转化为热能,“发热包”中可能含有下列物质中的( )
A. 氯化钠 B. 固体硝酸铵 C. 生石灰 D. 蔗糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 反应CaCO3(s)===CaO(s)+CO2(g)在常温下不能自发进行,则该反应的ΔH<0
B. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
C. 不能用玻璃瓶来盛装氟化钠水溶液
D. 常温下Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A常用于食品行业。已知4.5 g A在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重2.7 g和6.6 g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量为___,则A的分子式是____。

(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是________。
(3) A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是______。
(4)0.05 mol A与足量Na反应,在标准状况下产生H2的体积是________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 2Fe3+ +2I- =2Fe2+ +I2,2Fe2+ +Cl2 =2Fe3+ +2Cl-,则有关离子的还原性由强到弱的顺序为()
A.Cl->Fe2+>I-B.Fe2+>I->Cl-C.I->Fe2+>Cl-D.Fe2+>Cl->I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.含有共价键的化合物一定是共价化合物
B.非金属元素之间不可能形成离子化合物
C.气体分子间一定存在分子间作用力,但分子内不一定含共价键
D.两种不同的非金属元素形成的化合物只存在极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读、分析下列两个材料:
材料一、
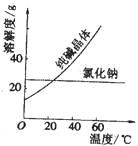
材料二、
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填写序号):
A.蒸馏法 | B.萃取法 | C.“溶解、结晶、过滤”的方法 | D.分液法 |
(1) 将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用__________。
(2)将乙二醇和丙三醇相互分离的最佳方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、P、Cl、Fe等元素及其化合物有重要的应用,回答下列问题:
(1)C原子的价电子轨道表达式为__________________ 。
(2)CC14分子的空间构型是______________,其中心原子采取______________杂化,与CC14互为等电子体的一种离子是__________________ (填写离子符号)。
(3)PC13属于________________分子(填“极性”或“非极性”)。
(4)FeO、NiO的晶体结构均与NaCl晶体结构相同,其中Fe2+与Ni2+的离子半径分别为 7.8×l0-2nm、6.9×l0-2nm,则熔点 FeO_________NiO (填 “>”、“ <”或“=”),原因是___________________。
(5)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为______________。
(6)已知Fe单质有如图所示的两种常见堆积方式:

其中属于体心立方密堆积的是___________(填“a”或“b”);若单质Fe按a方式紧密堆积,原子半径为rpm,NA表示阿伏加德罗常数的值,则单质Fe的密度为________g·cm-3 (列出算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com