
【题目】下列结构或物质一定没有核糖参与构成的是( )
A. 拟核 B. 酶 C. ATP D. 叶绿体
科目:高中化学 来源: 题型:
【题目】下列分离方法错误的是( )
A.除去混在植物油中的水——倾倒B.除去粗盐中的泥沙——过滤
C.用乙醚提取中草药中的有效成分——萃取D.除去氯气中的氯化氢气体——洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质,D为正盐。

请回答下列问题:
(1)写出各物质的名称:
A_____________ ; C_____________;D_____________。
(2)写出相应的离子方程式:
B→C: _____________________________;
C→D: ______________________________;
A→C: _____________________________;
D→E:_____________________________(任写一个即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前四周期的元素A、Z、Q、R、T的原子序数依次增大,且A、Z、Q同周期。A共有两个原子轨道上有电子,且电子数目相同。Z、Q相邻,且Z中的未成对电子数为3个,R元素在地壳中含量位于金属元素的第二位。T是人类最早使用的元素,并以这种元素命名了我国的一个时代。请回答下面的问题:
(1)A、Z、Q第一电离能从小到大的顺序为:_______________(填元素符号),T的价层电子排布图为:__________________________。
(2)Q的基态原子中能量最高的电子,其电子云在空间有___________个方向,原子轨道呈_______形。
(3)Z3-的立体构型为____________,写出与Z3-互为等电子体的一种非极性分子化学式____________。
(4)在不同的温度下,A以ACl2和二聚体A2Cl4两种形式存在,二聚体的结构式如图所示:
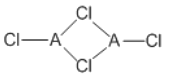
①ACl2中A的杂化方式为______________________。
②1mol A2Cl4中含配位键的数目为____________。
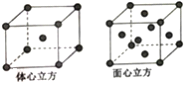
(5)R单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞的棱边长分别为acm、bcm,则R单质的体心立方晶胞和面心立方晶胞的密度之比为_________,R原子配位数之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷、乙烯、乙炔共同具有的性质是( )
A.都能发生聚合反应生成高分子化合物B.能够使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内D.都难溶于水,且密度比水小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关甲、乙的说法正确的是
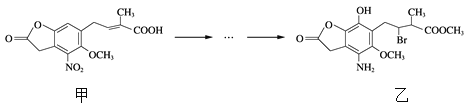
A. 甲的分子式为C14H14NO7
B. 甲、乙中各有1个手性碳原子
C. 可用NaHCO3溶液或FeCl3溶液鉴别化合物甲、乙
D. 乙能与盐酸、NaOH溶液反应,且1 mol乙最多能与5 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是

A. 遇FeCl3溶液显紫色,因为该物质与苯酚互为同系物
B. 滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C. 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol
D. 该分子中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氧化反应一定有氧气的参与B.得到电子,发生了还原反应
C.置换反应不一定是氧化还原反应D.所含元素化合价升高的物质被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。汽车内燃机工作时发生反应:N2(g)+O2(g)![]() 2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
(1)5 min内该反应的平均速率v(NO)=___________;在T℃时,该反应的平衡常数值为_________。
(2)反应开始至达到平衡的过程中,容器中下列各项发生变化的是(填序号)___________。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(3)已知:ⅰ.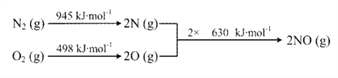
ⅱ. N2(g) + 2O2(g) === 2NO2(g) ΔH= + 68 kJ·mol-1
结合热化学方程式,说明温度对于NO生成NO2平衡转化率的影响:_____________________。
II. 含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(4)雾霾中能形成酸雨的物质是_____________
(5)NaClO2溶液可以吸收SO2、NO。在NaClO2溶液中通入含有SO2和NO的气体,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式________________________
增大压强,NO的转化率______(填“提高”“不变”或“降低”)。
②由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”)。原因除了SO2溶解性大于NO,还可能是___________________
(6)如图电解装置可将SO2、NO转化为(NH4)2SO4,
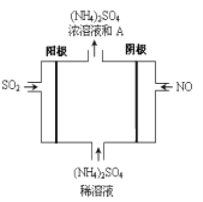
①阴极的电极反应式是______________________________
②SO2、NO通入电解装置中的体积比为___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com