
【题目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
科目:高中化学 来源: 题型:
【题目】乙烷、乙烯、乙炔共同具有的性质是( )
A.都能发生聚合反应生成高分子化合物B.能够使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内D.都难溶于水,且密度比水小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)B的轨道排布式是_____________________________________,A、B、C、D的第一电离能由小到大的顺序为___________________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.凡是放热反应的发生均无需加热
B.凡是需要加热后才能发生的反应是吸热反应
C.伴有能量变化的物质变化都是化学变化
D.物质发生化学反应都伴随着能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。汽车内燃机工作时发生反应:N2(g)+O2(g)![]() 2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
(1)5 min内该反应的平均速率v(NO)=___________;在T℃时,该反应的平衡常数值为_________。
(2)反应开始至达到平衡的过程中,容器中下列各项发生变化的是(填序号)___________。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(3)已知:ⅰ.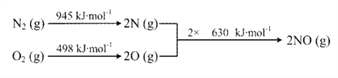
ⅱ. N2(g) + 2O2(g) === 2NO2(g) ΔH= + 68 kJ·mol-1
结合热化学方程式,说明温度对于NO生成NO2平衡转化率的影响:_____________________。
II. 含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(4)雾霾中能形成酸雨的物质是_____________
(5)NaClO2溶液可以吸收SO2、NO。在NaClO2溶液中通入含有SO2和NO的气体,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式________________________
增大压强,NO的转化率______(填“提高”“不变”或“降低”)。
②由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”)。原因除了SO2溶解性大于NO,还可能是___________________
(6)如图电解装置可将SO2、NO转化为(NH4)2SO4,
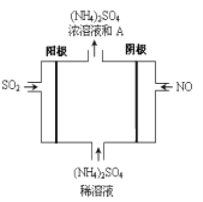
①阴极的电极反应式是______________________________
②SO2、NO通入电解装置中的体积比为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定分数是指滴定过程中标准溶液与待测溶液中溶质的物质的量之比。用0.10mol·L-1NaOH溶液滴定0.10mol·L-1H2C2O4(草酸)溶液的滴定曲线如图所示。下列说法不正确的是( )
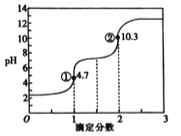
A. H2C2O4属于二元弱酸
B. 若用NaOH标准溶液滴定NaHC2O4溶液,可用酚酞作指示剂
C. 图中①处: c(Na+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
D. 图中②处:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关NH中的N—H配位键说法正确的是( )
A. N—H配位键不是化学键
B. N—H配位键属于共价键
C. N—H配位键跟其他三个N—H键之间的键长不同
D. N—H配位键的化学性质与其他N—H键不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体的晶胞结构如图。(该晶胞可看成由8个小立方体构成,在每个小立方体的体心各有一个黑球,在大立方体的8个顶点和6个面心上各有一个白球)试求:
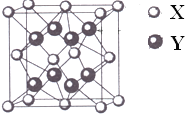
①晶体中每一个Y同时吸引着_____个X,每个X同时吸引着______个Y,该晶体的化学式是____________。
②晶体中在每个X周围与它最接近且距离相等X共有_____个。
③晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为___________。
④设该晶体的摩尔质量为M g/mol,晶胞密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个最近的X间中心距离为____________cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com