
【题目】下列性质中,可以证明某化合物内一定存在离子键的是( )
A.可溶于水B.固体不导电,熔融状态能导电
C.水溶液能导电D.有较高的熔点
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异成二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe2+的核外电子排布式__________。
(2)下列说法正确的是_______。
a.H2S和O3分子的构型相同
b.BF3和NH3分子的极性相同
c.CO2、HCN分子中C原子的杂化方式相同
d.CH3COOH分子中C原子的杂化方式相同
(3)N3-与CO2分子互为等电子体,则N3-的空间构型为_______。含Co3+的配合物Co[(N3)(NH3)5]SO4中的配体是_________。
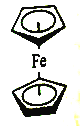
(4)二茂铁是由C5H5-和Fe2+形成的配合物,其结构如图所示。该配合物中共含有____种化学环境不同的氢。
(5)砷和氮位于同一主族,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,它们有着广泛的用途。同答下列问题:
①写出砷的价电子排布式___________。
②工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出该反应的化学方程式: ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列离子或物质的氧化性强弱顺序为:ClO3->BrO3->Cl2>IO3-,试回答下列问题:
(1)反应:Cl2+I2+H2O→HCl+HIO3能否发生?_____(填“能”或“不能”)。若能,请配平_______________。若不能,请说明理由____。
(2)已知反应:PbO2+4HCl(浓)= PbCl2+Cl2↑+2H2O,浓HCl的作用是__,二者个数之比为__,若生成标况下氯气28L,转移电子个数为____,请将其改写为离子方程式____。
(3)用双线桥表示下面的反应:(得失电子数、化合价变化情况、被氧化/被还原)___________
3MnO2+KClO2+6KOH=3K2MnO4+KCl+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中正确的是( )
A. KClO3在反应中是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 在反应中H2C2O4既不是氧化剂也不是还原剂
D. 1 mol KClO3参加反应有1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( )
A. 将CH3COONa溶液从20℃升温至30℃,溶液中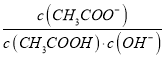 增大
增大
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol/L HCOOH 与 0.1 mol/L NaOH 等体积混合后:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol/L CH3COONa 与 0.1 mol/L盐酸等体积混合后 (pH<7):c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗结肠炎药物有效成分M的合成路线如下(部分反应略去试剂和条件):
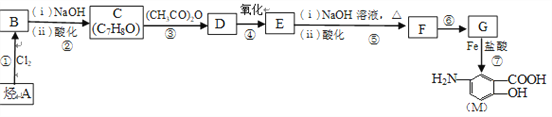
已知:
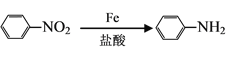
(1)烃A的结构简式是__________,G中的官能团名称是__________。
(2)反应①的反应条件是_________,反应⑥的反应类型是__________。
(3)下列对抗结肠炎药物有效成分M可能具有的性质推测正确的是________(填字母)。
A.既有酸性又有碱性 B.能发生消去反应
C.能发生加聚反应 D.1mol M与足量溴水充分反应,最多消耗1molBr2
(4)E与足量NaOH溶液反应的化学方程式是_______________________。
(5)写出符合下列条件的D的同分异构体的结构简式(任写一种)__________。
①属于芳香族化合物且苯环上有3个取代基
②能和NaHCO3溶液反应产生气体
③核磁共振氢谱有4组峰且峰面积之比为6∶2∶1∶1
(6)M在一定条件下可以发生缩聚反应生成含肽键的高分子化合物,写出该反应的化学方程式:_______________________________________________________
(7)已知:①![]() 易被氧化,②苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位。③苯环上连有羧基时再引入一个取代基,常取代在羧基的间位。参照以上的合成路线,设计一条以A为原料合成化合物
易被氧化,②苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位。③苯环上连有羧基时再引入一个取代基,常取代在羧基的间位。参照以上的合成路线,设计一条以A为原料合成化合物![]() 的合成路线。_______
的合成路线。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小分子抗癌药物的分子结构如图所示,下列说法正确的是

A. 1mol该有机物最多可以和5mol NaOH反应
B. 该有机物容易发生加成、取代、中和、消去等反应
C. 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D. 1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某刚性容器内有一活塞和弹簧,B为真空,A内已充入2molSO2和lmolO2,在一定条件下发生可逆反应2SO2+O2![]() 2SO3;△H=-QkJ/mol,(Q>0)—段时间后活塞己保持静止,SO2的反应速率为Y0。再往A内迅速充入2 molSO2和lmolO2,当活塞再次保持静止时,SO2的反应速率为Y,在此过程中,下列说法正确的是
2SO3;△H=-QkJ/mol,(Q>0)—段时间后活塞己保持静止,SO2的反应速率为Y0。再往A内迅速充入2 molSO2和lmolO2,当活塞再次保持静止时,SO2的反应速率为Y,在此过程中,下列说法正确的是
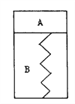
A. 活塞先下移,后上移到原静止位置,Y>Y0
B. 活塞先下移,后上移到原静止位置,Y = Y0
C. 活塞先下移,后上移但不到原静止位置,Y>Y0
D. 活塞先下移,后上移但不到原静止位置,Y = Y0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com