
【题目】某离子晶体的晶胞结构如图。(该晶胞可看成由8个小立方体构成,在每个小立方体的体心各有一个黑球,在大立方体的8个顶点和6个面心上各有一个白球)试求:
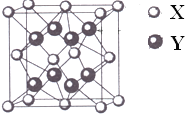
①晶体中每一个Y同时吸引着_____个X,每个X同时吸引着______个Y,该晶体的化学式是____________。
②晶体中在每个X周围与它最接近且距离相等X共有_____个。
③晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为___________。
④设该晶体的摩尔质量为M g/mol,晶胞密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个最近的X间中心距离为____________cm。
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行相应的实验(部分夹持装置略去),不能达到实验目的的是
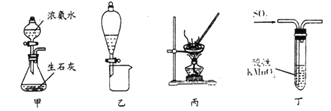
A. 利用图甲装置可快速制取少量氨气
B. 利用图乙装置分离水和溴的苯溶液
C. 利用图丙装置蒸发KCl溶液得晶体
D. 图丁装置中溶液颜色变浅,说明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下Al2O3(s)+AlCl3(g)+3C(s) =3AlCl (g)+3CO(g) △H = a kJ·mol-1
3AlCl(g)=2Al(l)+ AlCl3 (g) △H = b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示)。
②Al4C3也是该反应过程中的一种中间产物。Al4C3 与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为_______________。
③甲烷和水反应可以制水煤气(混合气体),在恒温、固定体积为V升的密闭容器中的反应微观示意图如下所示,根据微观示意图得出的结论中,正确的是_____________。
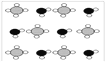
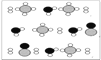
一定条件下经过t分钟达到化学平衡
a. 该反应方程式为:CH4+H2O = CO+3H2
b. 该反应平衡前后压强比为3:4
c. 该反应体系中含氢元素的化合物有3种
d. 该反应中甲烷的平衡转化率为50%
④水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac(aq) + CO(g) + NH3(g)![]() [Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是____________________。该条件下用气体表示的平衡常数表达式为:K=______________
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,一般在氩气环境中将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下可完全吸氢得到的混合物Y(含MgH2 和Al),Y在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_________________。
②写出镁铝合金(Mg17Al12 ) 在一定条件下完全吸氢的化学方程式 _________________。
③在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2 的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某刚性容器内有一活塞和弹簧,B为真空,A内已充入2molSO2和lmolO2,在一定条件下发生可逆反应2SO2+O2![]() 2SO3;△H=-QkJ/mol,(Q>0)—段时间后活塞己保持静止,SO2的反应速率为Y0。再往A内迅速充入2 molSO2和lmolO2,当活塞再次保持静止时,SO2的反应速率为Y,在此过程中,下列说法正确的是
2SO3;△H=-QkJ/mol,(Q>0)—段时间后活塞己保持静止,SO2的反应速率为Y0。再往A内迅速充入2 molSO2和lmolO2,当活塞再次保持静止时,SO2的反应速率为Y,在此过程中,下列说法正确的是
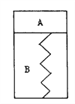
A. 活塞先下移,后上移到原静止位置,Y>Y0
B. 活塞先下移,后上移到原静止位置,Y = Y0
C. 活塞先下移,后上移但不到原静止位置,Y>Y0
D. 活塞先下移,后上移但不到原静止位置,Y = Y0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个化学方程式并配平。
________+________===________+________+________+________H2O
(2)反应物中发生氧化反应的物质为________,被还原的元素是________。
(3)反应中1 mol氧化剂得到________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内三种有机物的组成与功能关系图,请据图回答:
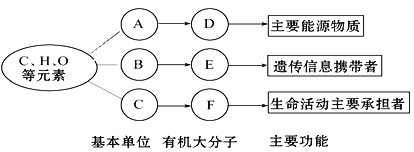
(1)小麦种子细胞中,物质D是_____________,人的肝细胞中物质D是________。
(2)相同质量的D和脂肪彻底氧化分解,耗氧量较多的是__________。
(3)C的化学名称是________。由C物质形成F的场所是_________。
(4)F在细胞中广泛存在,功能复杂多样,在鲜重中约占_________ ;若物质F在适宜的条件下能催化D水解,但过酸、过碱或温度过高会使F的__________破坏,使F永久失活。
(5)在HIV中,E物质的名称是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物X、Y 和高聚物Z,可以用烃A为主要原料,采用以下路线。
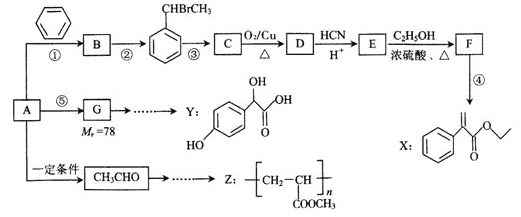
已知I.反应①、反应②的原子利用率均为100%。
II.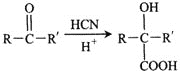 (R或R′可以是烃基或H原子)
(R或R′可以是烃基或H原子)
请回答下列问题:
(1)A的结构简式为________________。
(2)Z中的官能团名称为_____________________,反应③的条件为_________________。
(3) 关于药物Y(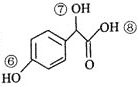 )的说法正确的是_____________________。
)的说法正确的是_____________________。
A.1mol 药物Y与足量的钠反应可以生成33.6L氢气
B.药物Y 的分子式为C8H8O4,能使酸性高锰酸钾溶液褪色
C.药物Y 中⑥、⑦、⑧三处-OH 的活泼性中强到弱的顺序是⑧>⑥>⑦
D.1mol药物Y与H2、浓溴水中的Br2反应,最多消耗分别为4mol和2mol
(4)写出反应E→F 的化学方程式________________。F→X的化学方程式_________________。
(5)写出符合下列条件的E的一种同分异构体的结构简式_________________________。
①FeCl3溶液可以发生显色反应,且是苯的二元取代物;
②能发生银镜反应和水解反应;
③核磁共振氢谱有6个峰。
(6)参考上述流程以CH3CHO和CH3OH为起始原料,其它无机试剂任选设计合成Z 的线路。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下两个反应:a.NaOH+HCl=NaCl+H2O b.Cu+2Ag+ =Cu2+ +2Ag
(1)反应____(填字母)不能设计成原电池。原因是__________________________。
(2)a反应为______反应(填“放热”或“吸热”),NaOH和HCl的总能量________(填“大于”“小于”或“等于”)NaCl和H2O的总能量。
(3)已知HCl中H-Cl键的键能为431 kJ·mol-1,则断开1molH-Cl键_____431 kJ的能量,形成1molH-Cl键_____431 kJ的能量。(填“吸收”或“放出”)
(4)反应____(填字母)能设计成原电池,请画出实验装置图,注明电极材料和电解质溶液。__________

写出电极反应式及反应类型
正极反应式:_____________________,
反应类型:_______________________,
负极反应式:_____________________。
(5)上题所设计原电池中,向正极移动的离子为_______,电池工作一段时间后,电解质溶液质量减轻7.6g,正极增重的质量为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com