
【题目】现有如下两个反应:a.NaOH+HCl=NaCl+H2O b.Cu+2Ag+ =Cu2+ +2Ag
(1)反应____(填字母)不能设计成原电池。原因是__________________________。
(2)a反应为______反应(填“放热”或“吸热”),NaOH和HCl的总能量________(填“大于”“小于”或“等于”)NaCl和H2O的总能量。
(3)已知HCl中H-Cl键的键能为431 kJ·mol-1,则断开1molH-Cl键_____431 kJ的能量,形成1molH-Cl键_____431 kJ的能量。(填“吸收”或“放出”)
(4)反应____(填字母)能设计成原电池,请画出实验装置图,注明电极材料和电解质溶液。__________

写出电极反应式及反应类型
正极反应式:_____________________,
反应类型:_______________________,
负极反应式:_____________________。
(5)上题所设计原电池中,向正极移动的离子为_______,电池工作一段时间后,电解质溶液质量减轻7.6g,正极增重的质量为_______。
【答案】a a不是氧化还原反应 放热 大于 吸收 放出 b 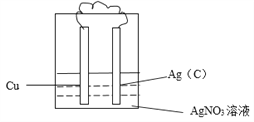 2Ag++2e-=2Ag 还原反应 Cu-2e-=Cu2+ Ag+ 10.8g
2Ag++2e-=2Ag 还原反应 Cu-2e-=Cu2+ Ag+ 10.8g
【解析】
(1)反应a不是氧化还原反应,所以不能设计成原电池;(2)a反应是中和反应,一定为放热反应,因此NaOH和HCl的总能量大于NaCl和H2O的总能量。(3)已知HCl中H-Cl键的键能为431 kJ·mol-1,则断开1molH-Cl键吸收431 kJ的能量,形成1molH-Cl键放出431 kJ的能量。(4)反应b是置换反应,属于氧化还原反应,能设计成原电池,铜失去电子,铜是负极,银离子得到电子,则装置图可以是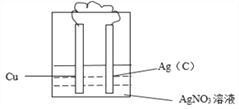 ,其中正极发生得到电子的还原反应,反应式为2Ag++2e-=2Ag,负极发生失去电子的氧化反应,反应式为Cu-2e-=Cu2+。(5)原电池中,阳离子向正极移动,则向正极移动的离子为Ag+。电池工作一段时间后,电解质溶液质量减轻7.6g,设消耗铜是xmol,则析出银是2xmol,所以2x×108-64x=7.6,解得x=0.05,所以正极增重的质量为0.1mol×108g/mol=10.8g。
,其中正极发生得到电子的还原反应,反应式为2Ag++2e-=2Ag,负极发生失去电子的氧化反应,反应式为Cu-2e-=Cu2+。(5)原电池中,阳离子向正极移动,则向正极移动的离子为Ag+。电池工作一段时间后,电解质溶液质量减轻7.6g,设消耗铜是xmol,则析出银是2xmol,所以2x×108-64x=7.6,解得x=0.05,所以正极增重的质量为0.1mol×108g/mol=10.8g。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】某离子晶体的晶胞结构如图。(该晶胞可看成由8个小立方体构成,在每个小立方体的体心各有一个黑球,在大立方体的8个顶点和6个面心上各有一个白球)试求:
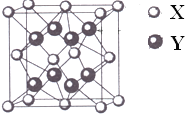
①晶体中每一个Y同时吸引着_____个X,每个X同时吸引着______个Y,该晶体的化学式是____________。
②晶体中在每个X周围与它最接近且距离相等X共有_____个。
③晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为___________。
④设该晶体的摩尔质量为M g/mol,晶胞密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个最近的X间中心距离为____________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验,判断下列叙述错误的是

A. 如图所示实验能够证明碳酸的酸性强于硅酸
B. 如图所示实验可证明元素的非金属性:Cl>C>Si
C. 如图所示实验中没有可以设计原电池的化学反应
D. 如图实验开始前需要打开分液漏斗的上口瓶塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是
A. S2Cl2的电子式为![]()
B. 固态时S2Cl2属于原子晶体
C. S2Cl2与NaOH的化学方程式可能为:S2Cl2+6NaOH=2NaCl+Na2SO3+Na2S+3H2O
D. S2Cl2是含有极性键和非极性键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-鸢尾酮香料的分子结构如图,下列说法不正确的是
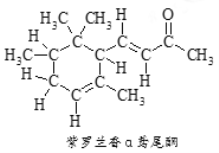
A. α-鸢尾酮可与某种酚互为同分异构体
B. 1 mol α-鸢尾酮最多可与3molH2加成
C. α-鸢尾酮能发生银镜反应
D. α-鸢尾酮经加氢→消去→加氢三步反应可转变为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在入住新装修的新房之前,下列做法错误的是
A. 紧闭门窗防止墙面干裂或变质 B. 适度开窗通风,充分进行室内外空气对流
C. 装修后空置一段时间后入住 D. 在各个房间适量放置吊兰,芦荟等植物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com