
(1)设转移电子的物质的量为x ,生成氧气的体积为V
2Cu2+ + 4e- = 2Cu
4 2
x 6.4g/(64g/mol)
4:x=2:0.1mol
x=0.2mol
根据电子守恒:
4OH- - 4e- = 2H2O + O2↑
4 4mol 22.4L
n(OH-) 0.2mol V
4mol:0.2mol =22.4L:V
V=1.12L
n(H+)=n(OH-)=0.2mol
c(H+)=0.2mol/2.0L=0.1mol/L
pH=-lgc(H+)=1
(2)用等质量的两块铜片代替石墨作电极,电极反应为: 阳极:Cu-2e-=Cu2+ 阴极:Cu2++2e-=Cu 根据转移电子守恒,阴极析出铜的质量和阳极溶解铜的质量相等,都是6.4g,电解后两铜片的质量相差为: 6.4g+6.4g=12.8g,溶液中c(H+)不变,pH不变。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济南市高三4月巩固性训练理综化学试卷(解析版) 题型:计算题
硫元素的化合物在生产、生活中有着广泛的应用。
(1)400℃,1.01× Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g)
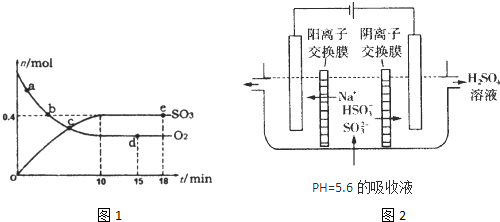
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
A.a点时刻的正反应速率比b点时刻的大
B.c点时刻反应达到平衡状态
C.d点和e点时刻的c(O2)相同
D.若5 00℃,1.01×105Pa下,反应达到平衡时,n( SO3) 比图中e点时刻的值大
(2)用NaOH溶液吸收工业废气中的SO2,当吸收液失去吸收能力时,25℃时测得溶液的pH=5.6,溶液中Na+,H+, HSO3-,SO32-离子的浓度由大到小的顺序是__________________。
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如下:

HSO3-在阳极室反应的电极反应式为________________________,阴极室的产物_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com