
在4 mol/L的氢氧化钠溶液中加入20 mL 2 mol/L的氯化铝溶液,振荡后无沉淀.若再滴入2 mol/L盐酸,当滴至20 mL时开始产生沉淀.
(1)求原来氢氧化钠溶液的体积.
(2)若再滴加2 mol/L的盐酸使产生的沉淀刚好消失,需加多少毫升?
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:上海市崇明县2011届高三上学期期末考试化学试题 题型:021
|
设NA为阿伏加德罗常数,下列叙述中正确的是 | |
A. |
常温下28 g乙烯和丙烯的混合物中总原子数为6 NA |
B. |
在标准状况下22.4 L乙醇中含有的碳原子数为2 NA |
C. |
0.2 mol/L的氢氧化钡溶液中含钡离子数为0.2 NA |
D. |
电解饱和食盐水若产生2 g氢气,转移的电子数为2 NA |
查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:填空题
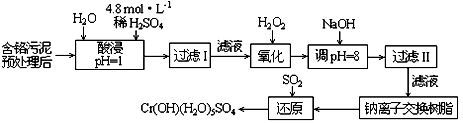
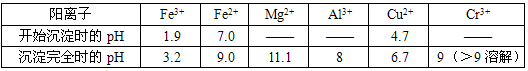
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题


查看答案和解析>>
科目:高中化学 来源:湖北省模拟题 题型:填空题


查看答案和解析>>
科目:高中化学 来源:福建省月考题 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com