
【题目】下列说法不正确的是( )
A.硅晶体和二氧化硅晶体中都含共价键
B.Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力越来越大
C.硫酸晶体和硫酸钠晶体均属于离子晶体
D.氯气和氯化氢分子中的氯原子的最外电子层都形成了具有8个电子的稳定结构
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】香草醛用作化妆品的香精和定香剂,也是食品香料和调味剂,还可做抗癫痫药。香草醛的分子结构如图所示。下列关于香草醛的说法中不正确的是( )

A.该化合物的分子式为C8H8O3
B.遇FeCl3溶液会显紫色
C.最多能与4 mol H2发生加成反应
D.该化合物可以发生加成反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱原理:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,需经过制取氨气、制取NaHCO3、分离及干燥NaHCO3四个步骤,下列图示装置能达到实验目的的是( )
A.制取氨气 B.制取NaHCO3
B.制取NaHCO3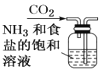
C.分离NaHCO3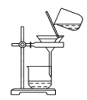 D.干燥NaHCO3
D.干燥NaHCO3 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向一带活塞的密闭容器中充入2mol![]() 和1mol
和1mol![]() ,发生下列反应:
,发生下列反应:![]() ,达到平衡后改变下述条件,
,达到平衡后改变下述条件,![]() 气体平衡浓度不变的是
气体平衡浓度不变的是![]()
A.保持温度和容器体积不变,充入1mol![]()
B.保持温度和容器内压强不变,充入1mol![]()
C.保持温度和容器体积不变,充入2mol![]() 和1mol
和1mol![]()
D.保持温度和容器内压强不变,充入1mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:A(g)+3B(g)![]() 2C(g);△H<0.有甲乙两个容积为0.5L的密闭容器,向甲容器中加入1molA的和3molB在一定条件下达到平衡时放出热量为Q1 kJ;在相同条件下,向乙容器中加入2mol C达到平衡时吸收热量为Q2kJ;已知Q2=3Q1.下列叙述不正确的是
2C(g);△H<0.有甲乙两个容积为0.5L的密闭容器,向甲容器中加入1molA的和3molB在一定条件下达到平衡时放出热量为Q1 kJ;在相同条件下,向乙容器中加入2mol C达到平衡时吸收热量为Q2kJ;已知Q2=3Q1.下列叙述不正确的是
A. 乙中C的转化率为75%
B. 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正小于v逆
C. 在该条件下,反应 2C(g)![]() A(g)+3B(g)的平衡常数为27×1.54
A(g)+3B(g)的平衡常数为27×1.54
D. 乙中的热化学方程式为2C(g)![]() A(g)+3B(g);△H=+Q2kJ/mol
A(g)+3B(g);△H=+Q2kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2=2AB的能量变化如下图所示,则下列说法不正确的是( )
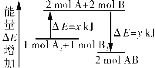
A.该反应是放热反应
B.断裂2 mol A—B键需要吸收![]() kJ的能量
kJ的能量
C.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
D.断裂1 mol A-A键和1 mol B-B键能吸收![]() kJ的能量
kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。

Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
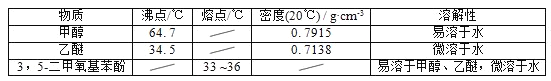
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A. Z为0.2 mol·L-1 B. Y2为0.35 mol·L-1
C. X2为0.3 mol·L-1 D. Z为0.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com