
【题目】下面所写的有机反应方程式及其类型都正确的是
A.  取代反应
取代反应
B. 2CH3CHO+ O2 → 2CH3COOH 氧化反应
C. CH2=CH2 + Br2 → CH3CHBr2 加成反应
D. HCOOH + CH3CH2OH ![]() HCOOCH3CH2+ H2O 取代反应
HCOOCH3CH2+ H2O 取代反应
【答案】B
【解析】A.是苯的硝化反应,注意硝基的书写,结合取代反应的特征分析判断;B.根据守恒关系分析,方程式是否正确,根据氧化反应的概念分析;C.根据加成反应的概念和特征分析判断;D.根据酯化反应的原理分析判断。
A.是苯的硝化反应,为取代反应,但硝基苯书写错误,应该写成![]() ,故A错误;B.2CH3CHO+O2 → 2CH3COOH,-CHO转化为-COOH,O原子增加,为氧化反应,故B正确;C.CH2=CH2 +Br2 → CH2Br CH2Br,产物的结构简式书写错误,故C错误;D.HCOOH+CH3CH2OH
,故A错误;B.2CH3CHO+O2 → 2CH3COOH,-CHO转化为-COOH,O原子增加,为氧化反应,故B正确;C.CH2=CH2 +Br2 → CH2Br CH2Br,产物的结构简式书写错误,故C错误;D.HCOOH+CH3CH2OH ![]() HCOOCH2CH3+H2O,产物书写错误,故D错误;故选B。
HCOOCH2CH3+H2O,产物书写错误,故D错误;故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是 ( )
A. 用溴水可鉴别苯、乙醇、苯乙烯![]()
B. 加浓溴水,然后过滤可除去苯中少量乙烯
C. 苯、溴水、铁粉混合制成溴苯
D. 可用分液漏斗分离硝基苯和苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
A.该反应的正反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中铋元素的数据如图,下列说法正确的是( ) 
A.Bi元素的质量数是209
B.Bi元素的相对原子质量是209.0
C.Bi原子6p亚层有一个未成对电子
D.Bi原子最外层有5个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质使用(括号内为用途)不正确的是( )
A.碳酸钠(发酵粉)B.Ca(ClO)2(消毒剂)
C.Al2O3(耐火材料)D.过氧化钠(供氧剂)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是_______
a.反应速率![]() ( NH3) =
( NH3) =![]() ( N2)
( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是![]() (正)____
(正)____![]() (逆)(填“﹥”、“﹤”或“﹦”),d点对应的速率关系是
(逆)(填“﹥”、“﹤”或“﹦”),d点对应的速率关系是![]() (正)____
(正)____![]() (逆)(填﹥、﹤或﹦)。
(逆)(填﹥、﹤或﹦)。

(2)298 K时,若已知生成标准状况下2.24 L NH3时放出热量为4.62 kJ。写出合成氨反应的热化学方程式_______。在该温度下,取1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于92.4 kJ,其原因是________。
(3)一定条件下,在2 L密闭容器内,反应2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 | |||
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
元素代号 | A | B | C | D | E | F | G | H | I |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.197 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +2 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,回答有关问题:
(1)元素G在周期表中的位置是_______,元素C的气态氢化物的电子式为_______。
(2)元素A、B、G可形成化合物B A4G,该化合物中存在的化学键有_______, E的单质晶体属于_______晶体(填“离子”、“分子”或“原子”),
(3)元素D、G、I的非金属性由强到弱的顺序是________(用元素符号表示),
(4)元素C、D的气态氢化物的稳定性顺序为_______(用化学式表示),元素D的单质可以将元素C从化合物A2C中置换出来,该置换反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据Ca(OH)2/CaO 体系的能量循环图:
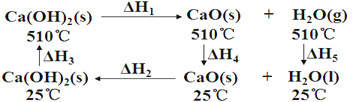
下列说法正确的是( )
A. △H5>0
B. △H1+△H2=0
C. △H3=△H4+△H2
D. △H1+△H2+△H3+△H4+△H5=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】始组鸟(pterodactyl adiene)形状如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是
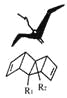
A. 始祖鸟烯与乙烯互为同系物
B. 若R1=R2=甲基,则其化学式C12H16
C. 若R1=R2=甲基,则始祖鸟烯的一氯代物有3种
D. 始祖鸟烯既能使酸性高锰酸钾褪色,也能使溴水褪色,则两反应的反应类型是相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com