
【题目】利用固体表面催化工艺进行NO分解的过程如下图所示。
![]()
下列说法不正确的是
A.NO属于共价化合物
B.O2含有非极性共价键
C.过程②吸收能量,过程③释放能量
D.标准状况下,NO分解生成11.2LN2转移电子数为6.02×1023
【答案】D
【解析】
A. NO中氮原子和氧原子以共价键相结合,NO只含有共价键,属于共价化合物,故A正确;
B. O2中氧原子和氧原子以共价键相结合形成分子,由同种元素形成的共价键为非极性键,故B正确;
C. 过程②为NO分子变成氮原子和氧原子,是断键的过程,断键吸收能量,过程③由氮原子和氧原子重新结合形成氮气和氧气,是形成化学键,形成键释放能量,故C正确;
D. 11.2LN2的物质的量为0.5mol,2molNO生成1mol N2,氮原子化合价由+2价变为0价,共转移4mol电子,则生成0.5mol N2转移电子数为2×6.02×1023=1.204×1024,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列各组离子在给定条件下能大量共存的是 ( )
A.在c(HCO![]() )="0.1" mol·L-1的溶液中:NH
)="0.1" mol·L-1的溶液中:NH![]() 、Al3+、Cl-、NO
、Al3+、Cl-、NO![]()
B.有大量![]() 存在的溶液中:Na+、Mg2+、Ca2+、I-
存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有大量![]() 存在的强酸性溶液中:NH
存在的强酸性溶液中:NH![]() 、Ba2+、Fe2+、Br-
、Ba2+、Fe2+、Br-
D.能使红色石蕊试纸变蓝的溶液中:SO![]() 、S2-、Na+、K+
、S2-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
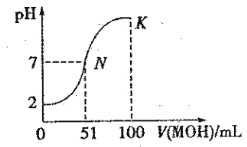
(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 。
(2)常温下一定浓度的MA稀溶液的pH = a,则a_________7(填“ > ”、“< ”或“=”),用离子方程式表示其原因:_____________________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:____________________。
(4)K点对应的溶液中,c(M+) +c(MOH)__________2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) =_____________mol· L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.明矾水解形成的Al(OH)3胶体能杀菌消毒,可用于水的净化
B.对2HI(g)![]() H2(g)+I2(g)平衡体系增加压强使颜色变深,能用勒夏特勒原理解释
H2(g)+I2(g)平衡体系增加压强使颜色变深,能用勒夏特勒原理解释
C.pH=6的某溶液一定呈酸性
D.二次电池充电时,电池上标有“+”的电极应与外接电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置可以将温室气体CO2转化为燃料气体CO.下列说法中,正确的是( )
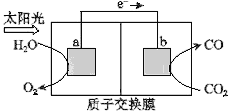
A.该装置工作时,H+从b极区向a极区移动
B.该装置中每生成1 mol CO,同时生成1 mol O2
C.电极a表面发生还原反应
D.该过程是将太阳能转化为化学能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2CO3是一种二元弱酸,常温下H2CO3水溶液中碳元素的存在形态的物质的量分数与溶液的pH的关系如图所示,据此分析,下列说法不正确的是( )

A.pH=8时,溶液中含碳元素的微粒主要是HCO3—
B.A点,溶液中H2CO3和HCO3-浓度相同
C.当c(HCO3-)=c(CO32-)时,c(H+)<c(OH-)
D.pH=8.4的水溶液中加入NaOH溶液时,发生反应的离子方程式可为:HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3,FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
Ⅰ.以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图所示:
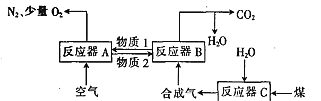
①C(s) +H2O(g) = CO(g)+ H2(g) ΔH = akJmol-1
②CO(g)+ H2(g) + O2(g) = CO2(g) +H2O(g) ΔH = bkJmol-1
(1)写出图中总反应的热化学方程式:_____________________________
(2)空气经反应器A后得到的尾气___________(填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____________________。
Ⅱ.用FeO作载氧剂,部分反应的lgKp [K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图所示。
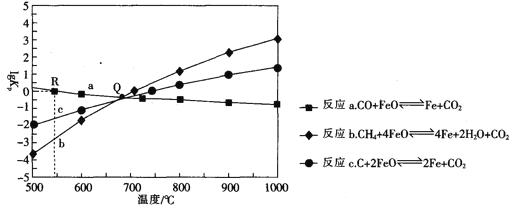
(3)图中涉及的反应中,属于吸热反应的是反应_________________(填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),则CO的平衡转化率为______________.
CO2(g) +Fe(s),则CO的平衡转化率为______________.
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp = _____________________.
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时反应向__________________(填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率___________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11,草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
①0.1mol·L-1Na2CO3溶液的pH____0.1mol·L-1Na2C2O4溶液的pH。(填“大于”“小于”或“等于”)
②碳酸钠溶液显碱性的原因是_____________________________ 。(用主要的离子方程式表示)
③若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是______(填字母)。
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
d.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
(2)用氨水除去SO2。
已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OH-)=________mol·L-1。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的c(SO32-)/c(HSO3-)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com