
【题目】H2CO3是一种二元弱酸,常温下H2CO3水溶液中碳元素的存在形态的物质的量分数与溶液的pH的关系如图所示,据此分析,下列说法不正确的是( )

A.pH=8时,溶液中含碳元素的微粒主要是HCO3—
B.A点,溶液中H2CO3和HCO3-浓度相同
C.当c(HCO3-)=c(CO32-)时,c(H+)<c(OH-)
D.pH=8.4的水溶液中加入NaOH溶液时,发生反应的离子方程式可为:HCO3-+OH-=CO32-+H2O
【答案】B
【解析】
A. 由图象可知,当pH=8时,溶液中HCO3-物质的量分数最大;
B. A点HCO3-的物质的量分数与CO2的碳酸溶液物质的量分数相同;
C. 当c(HCO3-)=c(CO32-)时,pH=10;
D. pH=8.4的水溶液主要是NaHCO3溶液,加入NaOH溶液时反应生成Na2CO3和水。
A. 由图象可知,当pH=8时,溶液中HCO3-物质的量分数最大,因此溶液中含碳元素的微粒主要是HCO3-,A项正确,不符合题意;
B. A点HCO3-的物质的量分数与CO2的碳酸溶液物质的量分数相同,溶液中H2CO3和HCO3-浓度不同,B项错误,符合题意;
C. 当c(HCO3-)=c(CO32-)时,pH=10,溶液为碱性,c(H+)<c(OH-),C项正确,不符合题意;
D. pH=8.4的水溶液主要是NaHCO3溶液,加入NaOH溶液时反应生成Na2CO3和水,离子方程式为:HCO3-+OH-=CO32-+H2O,D项正确,不符合题意;
答案选B。


科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是( )
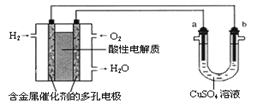
A. 燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的__________________区;溴的价电子排布式为______________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2 形式存在的。使氢氟酸分子缔合的作用力是____________________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是____________________(写出 名称)。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图 a、b 所示:
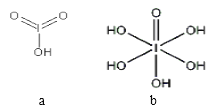
请比较二者酸性强弱:HIO3______________________H5IO6(填“>”、 “<”或“=”)。
(5)已知 ClO2-为 V 形,中心氯原子周围有四对价层电子。 ClO2-中心氯原子的杂化轨道类型为___________________,写 出一个 ClO2-的等电子体______________________。
(6)如图为碘晶体晶胞结构。有关说法中正确的是______________________。
A.碘分子的排列有 2 种不同的取向,2 种取向不同的碘分子 以 4 配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有 4 个碘原子
C.碘晶体中微粒(碘分子)的堆积为最密堆积
D.碘晶体中存在的相互作用有非极性键和范德华力
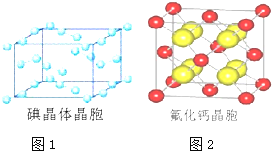
(7)已知 CaF2 晶体(见图)的密度为ρg/cm3,NA 为阿伏加德罗常数,棱上相邻的两个 Ca2+ 的核间距为 a cm, 则 CaF2 的相对分子质量可以表示为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在家中进行化学实验,按照图A连接好线路发现灯泡不亮,按照图B连接好线路发现灯泡亮.
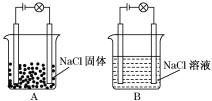
依据上述现象判断或回答下列问题:
(1)NaCl属于________(“酸”、“碱”或“盐”),因为__________________________.
(2)NaCl固体________(填“能”或“不能”)导电,原因是_____________________.
(3)NaCl溶液________(填“能”或“不能”)导电,原因是__________________.
(4)在NaCl固体、NaCl溶液中属于电解质的是_________________________________,
原因是____________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体表面催化工艺进行NO分解的过程如下图所示。
![]()
下列说法不正确的是
A.NO属于共价化合物
B.O2含有非极性共价键
C.过程②吸收能量,过程③释放能量
D.标准状况下,NO分解生成11.2LN2转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,下列有关叙述不正确的是( )

A. ③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
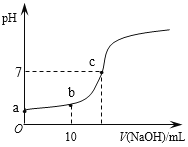
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国黄铜矿的储量比较丰富,主要产地集中在长江中下游地区、川滇地区、山西南部、甘肃的河西走廊以及西藏高原等地。黄铜矿是一种铜铁硫化物矿物,外观黄铜色,主要成分是CuFeS2,还含有少量的SiO2和Ni、Pb、Ag、Au等元素。为实现黄铜矿的综合利用,设计了如下的工艺流程。
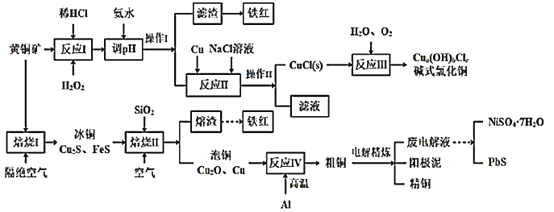
已知:①a、b、c均为整数;②CuCl+2Cl-![]() CuCl32-。
CuCl32-。
(1)CuFeS2中S的化合价为___。铁红的主要成分是___(填化学式)。
(2)实验测得“反应I”中有SO42-生成,该反应离子方程式为___,选H2O2溶液优于HNO3的原因是___。
(3)“反应II”中NaCl浓度过大,碱式氯化铜产率较低,其原因是____。
(4)写出“焙烧I”发生反应的化学方程式___。
(5)废电解液中含有少量的Pb2+,从废电解液中除去Pb2+的方法是往其中通人H2S至饱和,使Pb2+转化为硫化物沉淀,若废电解液的pH=4,为保证不生成NiS沉淀,Ni2+浓度应控制在___以下。(已知:饱和H2S溶液中c(H2S)为0.1mol/L,H2S的电离常数Ka1=1.0×10-7,Ka2=2.0×10-15,Ksp(NiS)=1.4×10-16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
B.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
C.常温下,0.1molL-1的①NH4Cl②CH3COONH4③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③
D.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com