
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
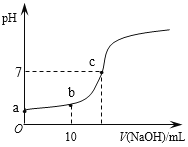
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
【答案】D
【解析】A、CH3COOH为弱酸,部分电离,a点为0.1 mol/L的CH3COOH溶液,c(H+)浓度小于0.1 mol/L,则pH大于1,故A错误;B、b点溶质为CH3COOH和CH3COONa,二者物质的量相等;溶液体积由20mL扩大为30mL,根据物料守恒c(CH3COOH)+c(CH3COO-)=0.1 mol/L×![]() ;CH3COOH的电离和CH3COO-的水解均是微弱的,则二者的浓度应均接近于
;CH3COOH的电离和CH3COO-的水解均是微弱的,则二者的浓度应均接近于![]() ≈0.033mol/L,不会等于0.05mol/L,故B错误; C、假设c点时,V(NaOH)=20mL,则CH3COOH与NaOH恰好完全反应生成CH3COONa,此时溶液显碱性,pH>7,与图不符,故假设不成立,故C错误;D、
≈0.033mol/L,不会等于0.05mol/L,故B错误; C、假设c点时,V(NaOH)=20mL,则CH3COOH与NaOH恰好完全反应生成CH3COONa,此时溶液显碱性,pH>7,与图不符,故假设不成立,故C错误;D、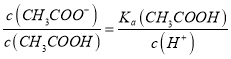 ,随着NaOH的加入,溶液的碱性逐渐增强,c(H+)逐渐减小,而温度不变,Ka不变,则
,随着NaOH的加入,溶液的碱性逐渐增强,c(H+)逐渐减小,而温度不变,Ka不变,则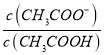 的值逐渐增大,故D正确。故选D。
的值逐渐增大,故D正确。故选D。


科目:高中化学 来源: 题型:
【题目】已知分解1mol H2O2放出热量98kJ,在含少量I- 的溶液中,H2O2分解的机理为①H2O2+I-→H2O+IO-(慢)、② H2O2+IO-→H2O+O2+I-(快)。下列有关该反应的说法不正确的是( )
A.过氧化氢分解快慢决定于反应慢的①
B.![]() 的分解速率与的
的分解速率与的![]() 浓度有关
浓度有关
C.该反应的催化剂是![]() ,而不是
,而不是![]()
D.由于催化剂的加入降低了反应的活化能,也改变了该反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、 (乙)、
(乙)、 (丙)的分子式均为C8H8,下列说法不正确的是
(丙)的分子式均为C8H8,下列说法不正确的是
A. 甲、乙、丙在空气口燃烧时均产生明亮并带有浓烟的火焰
B. 甲、乙、丙中只有甲的所有原子可能处于同一平面
C. 等量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲>乙
D. 甲、乙、丙的二氯代物数目最少的是丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各地对食品非法添加和滥用添加剂进行了多项整治活动。其中常用的面粉增白剂过氧化苯甲酰(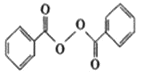 )也被禁用。下面是一种以苯为原料合成过氧化苯甲酰的流程:
)也被禁用。下面是一种以苯为原料合成过氧化苯甲酰的流程:
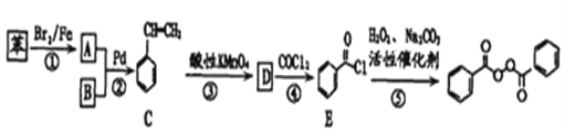
已知:R-X+![]()
请回答下列问题:
(1)结合过氧化苯甲酰结构分析,过氧化苯甲酰可以作为增白剂的原因是___。
(2)写出反应②的化学方程式___。
(3)某物质F为过氧化苯甲酰的同分异构体,同时符合下列条件的F的同分异构体有___种,请写出其中有三种不同化学环境的氢原子的结构简式:___。
①含有联苯(![]() )结构单元,无其他环状结构
)结构单元,无其他环状结构
②在一定条件下能发生银镜反应
③1molF最多可消耗4molNaOH
(4)请写出以苯乙烯为原料,合成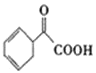 的流程,无机试剂任选,注明反应条件。____。
的流程,无机试剂任选,注明反应条件。____。
示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2![]() 2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列各物质在水中的电离方程式:
①NH3H2O__________________
②NaHSO4____________________
③NaHCO3____________________
④Fe2(SO4)3__________________
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)为__________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则c(OH-)为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖燃烧热的焓变依次是-393.5 kJ/mol、-285.8 kJ/mol、-890.31 kJ/mol、-2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5 kJ/mol
O2(g)=CO(g) ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g) ΔH=-571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.31 kJ/mol
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1 400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1 400 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行
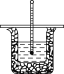
中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从实验装置上看,图中缺少的一种玻璃用品是_____________。
(2)实验中改用60 mL 0.50 mol/L盐酸与60 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”),所求得的中和热____(填“相等”或“不相等”),简述理由:___________________________________________。
(3)实验中改用6.94 mL 15 mol/L硫酸溶液跟60 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”),简述理由:_____________________________________________________________________
(4)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①3.3 ℃、②3.5 ℃、③4.5 ℃,则最终代入计算式的温差平均值为____℃。
(5)请利用上(4)小题的结论,计算该实验测得的中和反应反应热ΔH=____[设盐酸和NaOH溶液的密度为1 g/cm3,反应后混合溶液的比热容(c)为4.18 J/(g·℃)]。
(6)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和反应反应热为ΔH1,则ΔH1与原题中ΔH的关系为ΔH1____(填“<”“>”或“=”)ΔH,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com