
【题目】(1)写出下列各物质在水中的电离方程式:
①NH3H2O__________________
②NaHSO4____________________
③NaHCO3____________________
④Fe2(SO4)3__________________
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)为__________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则c(OH-)为___________。
【答案】NH3H2O![]() NH4++OH- NaHSO4=Na++H++ SO42- NaHCO3=Na++HCO3- Fe2(SO4)3=2Fe3++3SO42- 2.0×10-7mol/L 8×10-9mol/L
NH4++OH- NaHSO4=Na++H++ SO42- NaHCO3=Na++HCO3- Fe2(SO4)3=2Fe3++3SO42- 2.0×10-7mol/L 8×10-9mol/L
【解析】
(1)①NH3H2O是弱电解质,在溶液在存在电离平衡;
②NaHSO4在溶液中完全电离产生Na+、H+、SO42-;
③NaHCO3是盐,在溶液中完全电离产生Na+、HCO3-;
④Fe2(SO4)3完全电离产生Fe3+、SO42-。
(2)纯水电离产生的H+、OH-浓度相等;
先计算该温度下的水的离子积常数Kw,然后利用Kw=c(H+)·c(OH-)计算溶液中c(OH-)。
(1)①NH3H2O是弱电解质,在溶液在存在电离平衡,电离方程式为:NH3H2O![]() NH4++OH-;
NH4++OH-;
②NaHSO4在溶液中完全电离产生Na+、H+、SO42-,电离方程式为:NaHSO4=Na++H++ SO42-;
③NaHCO3是盐,在溶液中完全电离产生Na+、HCO3-,电离方程式为:NaHCO3=Na++HCO3-;
④Fe2(SO4)3完全电离产生Fe3+、SO42-,电离方程式为:Fe2(SO4)3=2Fe3++3SO42-。
(2)纯水存在电离平衡:H2O![]() H++OH-,根据电离方程式可知水电离产生的H+、OH-浓度相等。某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)=c(H+)=2.0×10-7mol/L,则该温度下水的离子积常数Kw= c(H+)·c(OH-)=2.0×10-7mol/L×2.0×10-7mol/L=4×10-14 mol2/L2;
H++OH-,根据电离方程式可知水电离产生的H+、OH-浓度相等。某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)=c(H+)=2.0×10-7mol/L,则该温度下水的离子积常数Kw= c(H+)·c(OH-)=2.0×10-7mol/L×2.0×10-7mol/L=4×10-14 mol2/L2;
若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则c(OH-)=Kw÷c(H+)=4×10-14 mol2/L2÷5.0×10-6mol/L=8×10-9mol/L。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 某放热反应能自发进行,则该反应一定是熵增的反应
B. 0.1 mol·L-1 CH3COONa溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)
C. pH相等的①(NH4)2SO4 ②NH4HSO4 ③NH4Cl三种溶液中,c(NH4+)大小:①>③>②
D. 某温度时水的离子积常数KW=10-12,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=9∶11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是![]()
A.反应速率用于衡量化学反应进行的限度
B.决定反应速率的主要因素是反应物本身的性质
C.放热的反应在常温下不一定都很容易发生
D.放热反应还是吸热反应主要由反应物断键吸收能量与生成物成键放出能量的相对大小决定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的说法正确的是 ( )
A.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
B.已知C(s)+![]() O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.当H为“-”时,表示该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
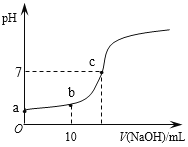
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式(或离子方程式)说明:
盐碱地产生碱性的原因:______________________________;
(2)请用离子方程式表示明矾净水的原理:_______________________
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________n(填“>”“<”或“=”)。
(4)25℃时,将amol·L-1氨水与0.01mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”)。
(5)如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是_____________。
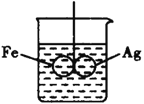
A.铁圈和银圈左右摇摆不定 B.铁圈和银圈保持平衡状态
C.铁圈向下倾斜,银圈向上倾斜 D.银圈向下倾斜,铁圈向上倾斜
写出银圈上的电极反应式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:![]()
![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.保持容器容积不变,向其中加入![]() ,反应速率一定加快
,反应速率一定加快
B.保持容器容积不变,向其中加入![]() (
(![]() 不参加反应),反应速率一定加快
不参加反应),反应速率一定加快
C.保持容器内气体压强不变,向其中加入![]() (
(![]() 不参加反应),反应速率一定加快
不参加反应),反应速率一定加快
D.保持容器内气体压强不变,向其中加入![]() 和
和![]() ,反应速率一定加快
,反应速率一定加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知C(石墨,s) = C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知2SO2(g)+O2(g) ![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
C.已知H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3kJ·mol-1,则任何酸碱中和反应的热效应数值均为57.3kJ
D.已知2C(s)+2O2(g) = 2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准浓度的氢氧化钠溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( )
①酸式滴定管用蒸馏水洗净后,未用盐酸润洗
②锥形瓶中盛有少量蒸馏水,再加待测液
③碱式滴定用蒸馏水洗净后,未用标准溶液润洗
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑤滴定后观察碱式滴定管读数时,视线高于刻度线
A.①④B.①③C.②⑤D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com