
【题目】在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:![]()
![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.保持容器容积不变,向其中加入![]() ,反应速率一定加快
,反应速率一定加快
B.保持容器容积不变,向其中加入![]() (
(![]() 不参加反应),反应速率一定加快
不参加反应),反应速率一定加快
C.保持容器内气体压强不变,向其中加入![]() (
(![]() 不参加反应),反应速率一定加快
不参加反应),反应速率一定加快
D.保持容器内气体压强不变,向其中加入![]() 和
和![]() ,反应速率一定加快
,反应速率一定加快
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl 转化为AgI
D.实验可以证明AgI比AgCI更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各地对食品非法添加和滥用添加剂进行了多项整治活动。其中常用的面粉增白剂过氧化苯甲酰(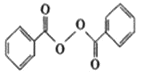 )也被禁用。下面是一种以苯为原料合成过氧化苯甲酰的流程:
)也被禁用。下面是一种以苯为原料合成过氧化苯甲酰的流程:
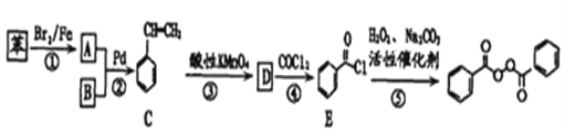
已知:R-X+![]()
请回答下列问题:
(1)结合过氧化苯甲酰结构分析,过氧化苯甲酰可以作为增白剂的原因是___。
(2)写出反应②的化学方程式___。
(3)某物质F为过氧化苯甲酰的同分异构体,同时符合下列条件的F的同分异构体有___种,请写出其中有三种不同化学环境的氢原子的结构简式:___。
①含有联苯(![]() )结构单元,无其他环状结构
)结构单元,无其他环状结构
②在一定条件下能发生银镜反应
③1molF最多可消耗4molNaOH
(4)请写出以苯乙烯为原料,合成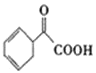 的流程,无机试剂任选,注明反应条件。____。
的流程,无机试剂任选,注明反应条件。____。
示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列各物质在水中的电离方程式:
①NH3H2O__________________
②NaHSO4____________________
③NaHCO3____________________
④Fe2(SO4)3__________________
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)为__________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则c(OH-)为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖燃烧热的焓变依次是-393.5 kJ/mol、-285.8 kJ/mol、-890.31 kJ/mol、-2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5 kJ/mol
O2(g)=CO(g) ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g) ΔH=-571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.31 kJ/mol
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1 400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1 400 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下NO2与SO2气体发生反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH=-41.8kJ·mol-1
SO3(g)+NO(g) ΔH=-41.8kJ·mol-1
将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明该反应达到平衡状态的是
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO3的同时生成1molNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行
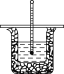
中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从实验装置上看,图中缺少的一种玻璃用品是_____________。
(2)实验中改用60 mL 0.50 mol/L盐酸与60 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”),所求得的中和热____(填“相等”或“不相等”),简述理由:___________________________________________。
(3)实验中改用6.94 mL 15 mol/L硫酸溶液跟60 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”),简述理由:_____________________________________________________________________
(4)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①3.3 ℃、②3.5 ℃、③4.5 ℃,则最终代入计算式的温差平均值为____℃。
(5)请利用上(4)小题的结论,计算该实验测得的中和反应反应热ΔH=____[设盐酸和NaOH溶液的密度为1 g/cm3,反应后混合溶液的比热容(c)为4.18 J/(g·℃)]。
(6)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和反应反应热为ΔH1,则ΔH1与原题中ΔH的关系为ΔH1____(填“<”“>”或“=”)ΔH,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.碱性锌锰干电池的负极反应式为:MnO2+2H2O-2e=Mn(OH)2+2OH
B.铅蓄电池放电时,正极反应式为PbO2+4H++SO42+2e=PbSO4+2H2O
C.NaHS水解反应方程式:HS+H2O ![]() H3O++S2
H3O++S2
D.过量的SO2通入到漂白粉溶液中,反应方程式:ClO+SO2+H2O=HClO+HSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3- )(填“>”、“<”或“=”)。
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是__________。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH) =___________。
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =___________。
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比_______。
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com