
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3- )(填“>”、“<”或“=”)。
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是__________。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH) =___________。
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =___________。
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比_______。
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于___________
【答案】< CH3COONa CN-+CO2+H2O=HCN+HCO3- CH3COO-+H2O![]() CH3COOH+OH- 1.8×104 36 10-6:1(或1:106) 5
CH3COOH+OH- 1.8×104 36 10-6:1(或1:106) 5
【解析】
(1)①酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小,根据表中数据知,酸的电离平衡常数:HCN<H2CO3,则水解程度:CN->HCO3-,酸根离子水解程度越大,其水溶液中酸根离子浓度越小;
②酸越弱,酸根离子的水解程度越大,加水稀释促进水解,溶液的pH变化越大;
③常温下,酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,电离平衡常数HCO3-<HCN<H2CO3,则酸性:HCO3-<HCN<H2CO3,则将少量CO2通入NaCN溶液,二者反应生成碳酸氢钠和HCN;
④室温下,一定浓度的CH3COONa溶液pH=9,醋酸钠是强碱弱酸盐,CH3COO-水解导致溶液呈碱性;溶液中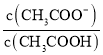 =
= =
=![]() ;
;
⑤已知①CH3COOH(aq) ![]() CH3COO-(aq) +H+(aq),②H2CO3(aq)
CH3COO-(aq) +H+(aq),②H2CO3(aq) ![]() HCO3-( aq) +H+(aq),由①-②可得CH3COOH(aq)+HCO3-( aq)
HCO3-( aq) +H+(aq),由①-②可得CH3COOH(aq)+HCO3-( aq) ![]() CH3COO-(aq) +H2CO3(aq),则该反应的平衡常数K =
CH3COO-(aq) +H2CO3(aq),则该反应的平衡常数K =![]() ;
;
⑥酸或碱抑制水电离,含有弱离子的盐促进水电离,则醋酸溶液中水电离出的c(H+)=![]() 、CH3COONa溶液中水电离出的c(H+)=10pH-14;
、CH3COONa溶液中水电离出的c(H+)=10pH-14;
(2)在常温下如果要生成Cu(OH)2沉淀,应满足c(Cu2+)×c2(OH-)≥2×10-20,以此计算溶液的c(OH-),可确定溶液的pH。
(1)①酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小,根据表中数据知,酸的电离平衡常数:HCN<H2CO3,则水解程度:CN->HCO3-,酸根离子水解程度越大,其水溶液中酸根离子浓度越小,所以存在c(CN-)<c(HCO3-);
②根据表中数据知,酸的电离平衡常数CH3COOH>H2CO3>HCN>HCO3-,则CO32-的水解程度最大,而CH3COO-的水解程度最小,将等浓度的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最大的是Na2CO3,最小的是CH3COONa;
③常温下,酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,电离平衡常数HCO3-<HCN<H2CO3,则酸性:HCO3-<HCN<H2CO3,则将少量CO2通入NaCN溶液,二者反应生成碳酸氢钠和HCN,离子方程式为CN-+CO2+H2O=HCN+HCO3-;
④室温下,一定浓度的CH3COONa溶液pH=9,醋酸钠是强碱弱酸盐,CH3COO-水解导致溶液呈碱性,水解离子方程式为CH3COO-+H2O![]() CH3COOH+OH-;溶液中
CH3COOH+OH-;溶液中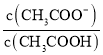 =
= =
=![]() =
=![]() =l.8×104;
=l.8×104;
⑤已知①CH3COOH(aq) ![]() CH3COO-(aq) +H+(aq),②H2CO3(aq)
CH3COO-(aq) +H+(aq),②H2CO3(aq) ![]() HCO3-( aq) +H+(aq),由①-②可得CH3COOH(aq)+HCO3-( aq)
HCO3-( aq) +H+(aq),由①-②可得CH3COOH(aq)+HCO3-( aq) ![]() CH3COO-(aq) +H2CO3(aq),则该反应的平衡常数K =
CH3COO-(aq) +H2CO3(aq),则该反应的平衡常数K =![]() =
=![]() =36;
=36;
⑥酸或碱抑制水电离,含有弱离子的盐促进水电离,则pH =4的CH3COOH溶液水电离出的c(H+)=![]() =
=![]() =10-10mol/L,pH =10的CH3COONa溶液中由水电离出的c(H+)=10pH-14=10-4mol/L,两溶液中水电离出的c(H+)的比值=10-10mol/L:10-4mol/L=10-6:1(或1:106);
=10-10mol/L,pH =10的CH3COONa溶液中由水电离出的c(H+)=10pH-14=10-4mol/L,两溶液中水电离出的c(H+)的比值=10-10mol/L:10-4mol/L=10-6:1(或1:106);
(2)已知Ksp=2×10-20,c(Cu2+)=0.02molL-1,在常温下如果要生成Cu(OH)2沉淀,则c(Cu2+)×c2(OH-)≥2×10-20,所以c(OH-)≥![]() =10-9(mol/L),应调节溶液pH大于5。
=10-9(mol/L),应调节溶液pH大于5。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:![]()
![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.保持容器容积不变,向其中加入![]() ,反应速率一定加快
,反应速率一定加快
B.保持容器容积不变,向其中加入![]() (
(![]() 不参加反应),反应速率一定加快
不参加反应),反应速率一定加快
C.保持容器内气体压强不变,向其中加入![]() (
(![]() 不参加反应),反应速率一定加快
不参加反应),反应速率一定加快
D.保持容器内气体压强不变,向其中加入![]() 和
和![]() ,反应速率一定加快
,反应速率一定加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=_________,V2=___________。
(2)根据上表中实验①、②的数据,可以得到的结论是_________________________________。
(3)探究温度对化学反应速率的影响,应选择__________(填实验编号)。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
该小组同学提出的假设是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准浓度的氢氧化钠溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( )
①酸式滴定管用蒸馏水洗净后,未用盐酸润洗
②锥形瓶中盛有少量蒸馏水,再加待测液
③碱式滴定用蒸馏水洗净后,未用标准溶液润洗
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑤滴定后观察碱式滴定管读数时,视线高于刻度线
A.①④B.①③C.②⑤D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将CO2通入2L pH=12的KOH溶液中,溶液中水电离出的OHˉ离子浓度(c)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是 ( )
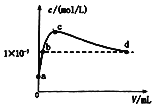
A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(K+)>c(CO32 -)>c(HCO3- )
C.c点溶液中: c(K+)=c(HCO3- )+c(CO32 -)+c(H2CO3)
D.d点溶液中: c(H+)=1×10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的原电池装置,下列叙述中正确的是( )
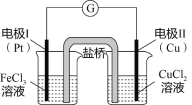
A.电极Ⅰ上发生还原反应,作原电池的负极
B.盐桥中装有含氯化钾的琼脂,其作用是传递电子
C.该原电池的总反应为: Fe3++Cu=Cu2++Fe2+
D.电极Ⅱ的电极反应式为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是( )
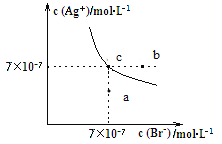
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯氧化铁是现代电子工业的重要材料.以下是用硫酸厂产生的烧渣![]() 主要成分为
主要成分为![]() 、
、![]() 、FeO、
、FeO、![]() 为原料制备高纯氧化铁
为原料制备高纯氧化铁![]() 软磁
软磁![]() 的生产流程示意图,下列说法不正确的是
的生产流程示意图,下列说法不正确的是![]()
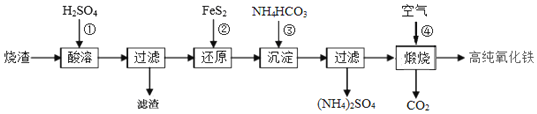
A.酸浸时,常需将烧渣粉碎、并加入过量![]() ,其目的是提铁元素的浸出率,同时抑制铁离子的水解
,其目的是提铁元素的浸出率,同时抑制铁离子的水解
B.加入![]() 时,发生反应
时,发生反应![]() 的离子方程式为
的离子方程式为![]()
C.加入![]() 为了生成
为了生成![]() ,检验
,检验![]() 是否洗涤干净的方法是取最后一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净
是否洗涤干净的方法是取最后一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净
D.煅烧时空气中的氧气作氧化剂,所以用氯气代替空气也可得到高纯氧化铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知: ![]() ≈2.4,
≈2.4, ![]() ≈3.2) ( )
≈3.2) ( )

A. M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 与P点相对应的NiS的分散系是均一稳定的
C. 向Q点对应的溶液中加水,可转化成N点对应的溶液
D. FeS+Ni2+![]() NiS+Fe2+的平衡常数K=6000
NiS+Fe2+的平衡常数K=6000
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com