
【题目】室温下,将CO2通入2L pH=12的KOH溶液中,溶液中水电离出的OHˉ离子浓度(c)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是 ( )
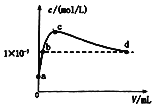
A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(K+)>c(CO32 -)>c(HCO3- )
C.c点溶液中: c(K+)=c(HCO3- )+c(CO32 -)+c(H2CO3)
D.d点溶液中: c(H+)=1×10-7mol/L
【答案】C
【解析】
a点为氢氧化钾溶液,a到c是生成碳酸钾,b点是碳酸钾和氢氧化钾的混合溶液,c点是单一的碳酸钾溶液,c到d是生成碳酸氢钾,d点是碳酸氢钾和碳酸的混合溶液,d点溶液呈中性。
a点为氢氧化钾溶液,a到c是生成碳酸钾,b点是碳酸钾和氢氧化钾的混合溶液,c点是单一的碳酸钾溶液,c到d是生成碳酸氢钾,d点是碳酸氢钾和碳酸的混合溶液,d点溶液呈中性;
A.a点溶液中的溶质是KOH,氢氧化钾抑制了水的电离,溶液中氢离子是水电离的,则水电离出的c(H+)=10-pH=1×10-12molL-1,故A正确;
B.b点溶液中所含有的溶质应为K2CO3和KOH,其中CO32-部分水解,则溶液中c(K+)>c(CO32 -)>c(HCO3-),故B正确;
C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钾溶液,根据碳酸钾溶液中的物料守恒可得:c(K+)=2[c(CO32-)+c(HCO3)+c(H2CO3)],故C错误;
D.d点溶液中水电离出的OH-离子浓度10-7mol/L,溶液呈中性,则pH=7,故D正确;
故答案为C。


科目:高中化学 来源: 题型:
【题目】25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖燃烧热的焓变依次是-393.5 kJ/mol、-285.8 kJ/mol、-890.31 kJ/mol、-2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5 kJ/mol
O2(g)=CO(g) ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g) ΔH=-571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.31 kJ/mol
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1 400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1 400 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( )
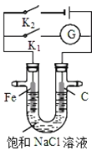
A.K1闭合,石墨棒周围溶液pH逐渐降低
B.K1闭合,铁棒上发生的反应为2H+ + 2e= H2↑
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极保护法
D.K2闭合,电路中通过0.2NA个电子时,两极共产生标况下4.48L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应2NO2(g)N2O4(g)△H<0,达到平衡时NO2的体积分数与温度、压强的关系如图所示.下列说法正确的是 ( )
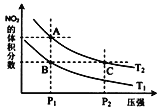
A.温度:T1>T2
B.A、B两点对应的平衡常数:KA>KB
C.A点:2v(NO2)正 ═ v(N2O4)逆
D.B、C两点气体的平均摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3- )(填“>”、“<”或“=”)。
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是__________。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH) =___________。
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =___________。
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比_______。
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应 2NO2(g)![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应, 达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中反应, 达到平衡状态的标志是( )
①单位时间内生成 n mol O2,同时生成 2n mol NO2
②v 正(NO)=v 逆(NO2)
③每消耗 32g 氧气,同时生成 60g NO
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
⑦混合气体的密度不再改变
A.①④⑤⑥B.①②③⑤C.①②③④⑤D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸与醋酸钠组成的缓冲溶液对酸碱有一定的缓冲作用,缓冲能力与组分的浓度有关。室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.1 mol·L1 CH3COOH溶液:c(CH3COOH)> c(CH3COO-) > c(H+)>c(OH-)
B.pH=8的CH3COOH和CH3COONa混合溶液:c(Na+)﹣c(CH3COO-) =9.9×10-7 mol·L-1
C.0.1 mol·L1CH3COOH溶液和0.2 mol·L-1CH3COONa溶液等体积混合:2c(Na+)= 3c(CH3COO-)+3c(CH3COOH)
D.0.2 mol·L-1CH3COOH溶液和0.1 mol·L-1NaOH溶液等体积混合:c(CH3COOH)+ 2c(H+)=c(CH3COO-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙,甲是常见温室效应气体。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物,其转化关系如图所示。下列判断不正确的是

A.反应①②③都属于氧化还原反应B.X、Y、Z、W四种元素中,W的原子半径最大
C.在信息工业中,丙常作光导纤维材料D.一定条件下,x与甲反应生成丁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com