
【题目】用标准浓度的氢氧化钠溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( )
①酸式滴定管用蒸馏水洗净后,未用盐酸润洗
②锥形瓶中盛有少量蒸馏水,再加待测液
③碱式滴定用蒸馏水洗净后,未用标准溶液润洗
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑤滴定后观察碱式滴定管读数时,视线高于刻度线
A.①④B.①③C.②⑤D.③④
【答案】D
【解析】
①取未知浓度盐酸的酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗,待测液的物质的量偏小,导致V(标准)偏小,根据c(待测)=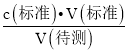 可知,c(待测)偏小,故①错误;
可知,c(待测)偏小,故①错误;
②锥形瓶中有少量蒸馏水,待测液的物质的量不变,则V(标准)不变,根据c(待测)=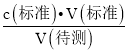 可知,c(待测)不变,故②错误;
可知,c(待测)不变,故②错误;
③碱式滴定管用蒸馏水洗净后未用标准溶液润洗,标准溶液浓度减小,导致V(标准)偏大,根据c(待测)=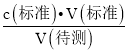 可知c(待测)偏大,故③正确;
可知c(待测)偏大,故③正确;
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失,导致V(标准)偏大,根据c(待测)=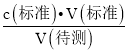 可知,c(待测)偏大,故④正确;
可知,c(待测)偏大,故④正确;
⑤滴定后观察碱试滴定管读数时,视线高于刻度线,导致V(标准)偏小,根据c(待测)=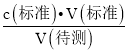 可知,c(待测)偏小,故⑤错误;
可知,c(待测)偏小,故⑤错误;
③④正确,故答案为D。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】(1)写出下列各物质在水中的电离方程式:
①NH3H2O__________________
②NaHSO4____________________
③NaHCO3____________________
④Fe2(SO4)3__________________
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)为__________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则c(OH-)为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.碱性锌锰干电池的负极反应式为:MnO2+2H2O-2e=Mn(OH)2+2OH
B.铅蓄电池放电时,正极反应式为PbO2+4H++SO42+2e=PbSO4+2H2O
C.NaHS水解反应方程式:HS+H2O ![]() H3O++S2
H3O++S2
D.过量的SO2通入到漂白粉溶液中,反应方程式:ClO+SO2+H2O=HClO+HSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学反应原理,解决以下问题:
(1)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,请回答下列问题:
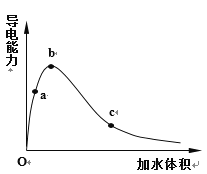
①写出冰醋酸电离方程式____________
②加水过程中,其水溶液导电能力变化的原因是:_______________________________________
③a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:__________(填“相同”、“a点大”、“b点大”、“c点大”)
(2)常温下,将0.2 mol·L-1的CH3COOH和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH=5(溶液体积变化忽略不计),则该溶液中:
c(CH3COO) + c(CH3COOH)= _______mol/L
c(H+) - c(CH3COO)+ c(Na+) = _______mol/L
(3)KAl(SO4)2·12H2O可做净水剂,其原理是____________________________________(用离子方程式表示)
(4)在0.10 mol·L-1 Na2SO3溶液中,离子浓度由大到小的顺序为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.在中和热测定实验中,为准确测得反应前后的温差,应将已分别测得温度的氢氧化钠溶液与盐酸在隔热的容器中快速混合,并不断搅拌,用温度计测量混合液的最高温度
B.往海带灰的浸泡液中加入过量的氯水,保证![]() 完全氧化为
完全氧化为![]()
C.将溴乙烷与氢氧化钾混合液加热,再滴加硝酸银溶液,观察有淡黄色沉淀生成,可证明溴乙烷中含有溴
D.润洗酸式滴定管时应从滴定管上口加入![]() 所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复
所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复![]() 次
次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3- )(填“>”、“<”或“=”)。
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是__________。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH) =___________。
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =___________。
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比_______。
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的个数有( )
①氧原子的电子排布图:![]() 最外层违背了泡利原理
最外层违背了泡利原理
②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③所有元素中,氟的第一电离能最大
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥金属元素的电负性均小于2
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
A.0个B.1个C.2个D.3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知次氯酸是比碳酸还弱的酸,反应Cl2 + H2O![]() HCl + HClO达平衡后,要使HClO浓度增大,可加入
HCl + HClO达平衡后,要使HClO浓度增大,可加入
A.足量6mol/L NaOH溶液 B.少量6mol/L H2SO4溶液
C.少量NaHCO3固体 D.足量Na2SO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com