
【题目】如图是某同学设计的原电池装置,下列叙述中正确的是( )
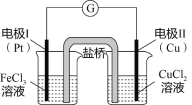
A.电极Ⅰ上发生还原反应,作原电池的负极
B.盐桥中装有含氯化钾的琼脂,其作用是传递电子
C.该原电池的总反应为: Fe3++Cu=Cu2++Fe2+
D.电极Ⅱ的电极反应式为:Cu-2e-=Cu2+
科目:高中化学 来源: 题型:
【题目】下列关于![]() 水解的说法错误的是( )
水解的说法错误的是( )
A.在稀溶液中,水解达到平衡时,无论加![]() 饱和溶液还是加水稀释,平衡均向右移动
饱和溶液还是加水稀释,平衡均向右移动
B.浓度为![]() 和
和![]() 的两种
的两种![]() 溶液,其他条件相同时,
溶液,其他条件相同时,![]() 的水解程度前者小于后者
的水解程度前者小于后者
C.其他条件相同时,同浓度的![]() 溶液在50 ℃和20 ℃时发生水解,50 ℃时
溶液在50 ℃和20 ℃时发生水解,50 ℃时![]() 的水解程度比20 ℃时的小
的水解程度比20 ℃时的小
D.为抑制![]() 的水解,更好地保存
的水解,更好地保存![]() 溶液,应加少量盐酸
溶液,应加少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO+H+ ΔH>0。
CH3COO+H+ ΔH>0。
(1)常温常压下,在pH=5的稀醋酸溶液中,c(CH3COO)=__;(精确值)下列方法中,可以使0.10mol·L-1CH3COOH的电离程度增大的是___。
a.加入少量0.10mol·L1的稀盐酸 b.加热CH3COOH溶液 c.加入少量冰醋酸 d.加水稀释至0.010mol·L-1 e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)已知:90℃时,水的离子积常数为Kw=38×10-14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=___(保留三位有效数字)。
(3)现有浓度均为0.1mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨水,请回答下列问题:
ⅰ.①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)__。
ⅱ.④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)___。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)如图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式 _________________________________________。
(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1 ______ K2(填“>”、“=” 或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v正(N2) = v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应 2NH3(g) ![]() N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
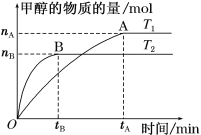
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______mol·L1·min1。
②图示的温度T1______T2(填“>”、“=” 或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。

下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向一容积可变的密闭容量中充入2 mol X,发生反应:2X(g)![]() Y(g)+2Z(g),达到平衡后改变下述条件,气体Z的平衡浓度不变的是( )
Y(g)+2Z(g),达到平衡后改变下述条件,气体Z的平衡浓度不变的是( )
A. 恒温恒压下,充入1 mol X(g) B. 恒温恒容下,充入1 mol Y(g)
C. 恒温恒压下,充入2 mol Z(g) D. 恒温恒压下,充入1 mol He(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是( )
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液为碱性
D.VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解 |
(1)实验室用18.4molL-1的浓硫酸配制250mL4.8molL-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和移液管(一种能精确量取一定体积液体的仪器)外,还需___。
(2)酸浸时,为了提高浸取率可采取的措施是___(至少两条)。
(3)加入H2O2的作用是___。
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是___。
(5)还原过程发生以下反应(请配平):__Na2Cr2O7+__SO2+__=__Cr(OH)(H2O)5SO4+__Na2SO4;
(6)从流程的滤液中可回收的主要物质是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的用途及性质的说法正确的是
A.乙烯使酸性KMnO4溶液或溴的CCl4溶液褪色的原理相同
B.苯与液溴在催化剂作用下生成溴苯发生了加成反应
C.淀粉、蛋白质等营养物质在人体内水解生成水和CO2等
D.用K2Cr2O7检验司机是否酒驾利用了乙醇的挥发性和还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com