
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
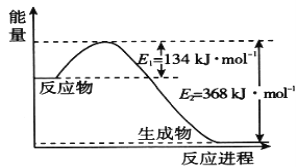
(1)如图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式 _________________________________________。
(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1 ______ K2(填“>”、“=” 或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v正(N2) = v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应 2NH3(g) ![]() N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
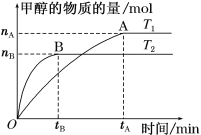
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______mol·L1·min1。
②图示的温度T1______T2(填“>”、“=” 或“<”)。
【答案】NO2(g)+CO(g)= NO(g)+CO2(g) ΔH=234 kJ mol1 > bc 2 > ![]() <
<
【解析】
(1)根据能量变化图,反应热等于正反应的活化能减去逆反应的活化能;
(2)①对于放热反应,温度越高,平衡逆向移动,反应平衡常数越小;
②根据平衡状态的判断依据判断;
③400℃时,N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数 K =0.5,反应 2NH3(g)
2NH3(g) ΔH<0,其化学平衡常数 K =0.5,反应 2NH3(g) ![]() N2(g) + 3H2(g) 的平衡常数K为
N2(g) + 3H2(g) 的平衡常数K为![]() =2;
=2;
根据浓度熵和平衡常数的关系来确定平衡的移动方向;
(3)①结合v=△c÷△t计算;
②由图T2先达到平衡,温度高,速度快,图示的温度T1<T2。
(1)该反应的焓变△H=E1-E2=134KJ·mol-1-368KJ·mol-1=-234KJ·mol-1,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ·mol-1;
(2)①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2;
②a、容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故a错误;
b、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3v正(N2) = v逆(H2)
是平衡状态,故b正确;
c、容器内压强不变,气体的物质的量不变,该反应达平衡状态,故c正确;
d、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故d错误;
故选bc;
③400℃时,N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数 K =0.5,反应 2NH3(g)
2NH3(g) ΔH<0,其化学平衡常数 K =0.5,反应 2NH3(g) ![]() N2(g) + 3H2(g) 的平衡常数K为
N2(g) + 3H2(g) 的平衡常数K为![]() =2;
=2;
,400℃时,浓度商Qc=2×13÷32=<K,说明反应正向进行,因此有v正(N2)>v逆(N2);
(3)①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=△c÷△t=![]() ==
== ![]() mol·L1·min1。
mol·L1·min1。
②由图T2先达到平衡,温度高,速度快,图示的温度T1<T2。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】药物瑞德西韦(Remdesivir)对新冠病毒有明显抑制作用,化合物 M是合成瑞德西韦的中间体,下列关于M的说法错误的是

A.核磁共振氢谱共有11个吸收峰
B.分子中含有3种含氧官能团
C.分子中N原子一个是sp2杂化,一个是sp3杂化
D.1mol该物质与足量NaOH溶液反应时消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关![]() 反应的叙述正确的为
反应的叙述正确的为
A.还原剂与氧化剂物质的量之比为5:3
B.生成lmolO2,反应共转移4mol电子
C.若有5mol水做还原剂时,被BrF3还原的BrF3为![]() mol
mol
D.若有5mol水参与反应时,被水还原的BrF3为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.8×10﹣31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于_____(填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因__________________________。
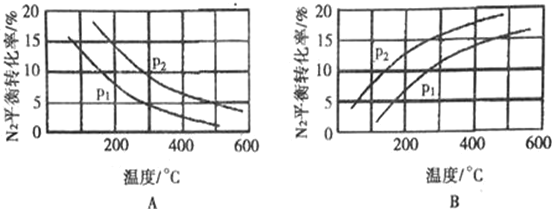
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是___(填“A”或“B”);比较P1、P2的大小关系:P1______P2(填“>”、“=” 或“<”)。
Ⅱ. 目前工业合成氨的原理是:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(3)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。达平衡时,H2的转化率α1=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国大会将2019年定为“化学元素周期表国际年”,显示了元素周期律的重要性。下表列出了a~j10种元素在周期表中的位置:
周期 | IA | 0 | |||||||
1 | a | IIA | … | IIIA | IVA | VA | VIA | VIIA | |
2 | b | … | e | d | |||||
3 | c | f | … | g | h | i | j |
(1)因在元素b的电池材料领域做出了杰出贡献,97岁的古迪纳夫荣获2019年诺贝尔化学奖,b原子结构示意图为____;此类电池工作时,将___能转化为电能。
(2)a~j10种元素中,最外层电子数比K层电子数多的元素有___种(填数字);金属性最强的元素有_____(写元素符号)。
(3)元素g的最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为:_______;
(4)h、i、j三种元素的气态氢化物中,最稳定的氢化物是______(写化学式);
(5)元素i的一种氧化物常用于漂白纸浆、草帽辫等。该氧化物具有还原性,在一定条件下能与常见氧化剂发生反应,写出其中一个反应的化学方程式:_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F用于制造香精,可利用下列路线合成。回答下列问题:
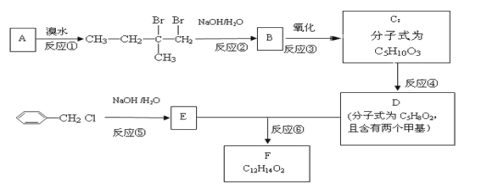
(1)A的化学名称是___。
(2)B的结构简式是___。
(3)①~⑥中属于取代反应的有___(填序号)。
(4)反应⑥的化学方程式为___。
(5)C有多种同分异构体,与C具有相同官能团的有__种(不包括C),其中核磁共振氢谱为四组峰的结构简式为___(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的原电池装置,下列叙述中正确的是( )
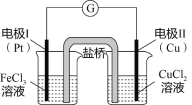
A.电极Ⅰ上发生还原反应,作原电池的负极
B.盐桥中装有含氯化钾的琼脂,其作用是传递电子
C.该原电池的总反应为: Fe3++Cu=Cu2++Fe2+
D.电极Ⅱ的电极反应式为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是( )
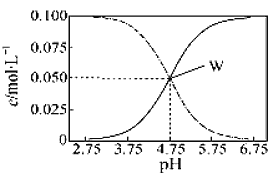
A.pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示的1.0L溶液中通入0.05molHCl气体(忽略溶液体积变化):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的坚硬金属,铬的工业用途很广,主要有金属加工、电镀、制革行业,这些行业排放的废水和废气是环境中的主要污染源。请回答下面与铬有关的一些问题。
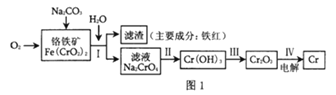
(1)工业上冶炼铬的主要步骤如图1所示:
①已知步骤Ⅱ的反应方程式为:8Na2CrO4+6Na2S+23H2O=8Cr(OH)3↓+3Na2S2O3+22NaOH。该反应中氧化剂是___(填化学式),生成1molCr(OH)3时转移电子的物质的量为___mol;
②步骤IV中电解Cr2O3的阳极反应式为___;
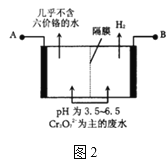
(2)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图2,A为电源的___(填“正极”“负极”),阳极区溶液中发生的氧化还原反应为___。
(3)化学需氧量(COD)可量度水体受有机物污染的程度。它是在强酸并加热条件下,用K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量,换算成相当于O2的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取VamL水样于锥形瓶,加入10.00mL0.2500mol/L K2Cr2O7溶液;
Ⅱ.加碎瓷片少许,然后慢慢加入少量硫酸,混合均匀,加热;
Ⅲ.反应完毕后,冷却,加指示剂,用cmol/L的硫酸亚铁铵(NH4)2Fe(SO4)2溶液滴定。终点时消耗硫酸亚铁铵溶液VbmL(此步操作的目的是用Fe2+把多余的Cr2O72-反应成Cr3+)。
①Ⅰ中,量取K2Cr2O7溶液的仪器是___;
②Ⅱ中,碎瓷片的作用是___;
③该水样的化学需氧量COD=___(用含c、Va、Vb的表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com