
【题目】现有室温下四种溶液,有关叙述不正确的是( )
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液为碱性
D.VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知反应![]() ,为研究影响该反应速率的因素,在不同条件下进行4组实验,Y、Z的起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。下列说法不正确的是( )
,为研究影响该反应速率的因素,在不同条件下进行4组实验,Y、Z的起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。下列说法不正确的是( )
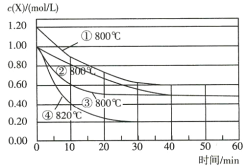
A.若实验②、④只改变一个条件,则由实验②、④得出结论:升高温度,化学反应速率加快
B.若实验①、②只改变一个条件,则由实验①、②得出结论:增大反应物浓度,化学反应速率加快
C.若实验②、③只改变一个条件,则实验③使用了催化剂
D.0~10min内,实验③的平均速率v(Y)=0.04 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国大会将2019年定为“化学元素周期表国际年”,显示了元素周期律的重要性。下表列出了a~j10种元素在周期表中的位置:
周期 | IA | 0 | |||||||
1 | a | IIA | … | IIIA | IVA | VA | VIA | VIIA | |
2 | b | … | e | d | |||||
3 | c | f | … | g | h | i | j |
(1)因在元素b的电池材料领域做出了杰出贡献,97岁的古迪纳夫荣获2019年诺贝尔化学奖,b原子结构示意图为____;此类电池工作时,将___能转化为电能。
(2)a~j10种元素中,最外层电子数比K层电子数多的元素有___种(填数字);金属性最强的元素有_____(写元素符号)。
(3)元素g的最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为:_______;
(4)h、i、j三种元素的气态氢化物中,最稳定的氢化物是______(写化学式);
(5)元素i的一种氧化物常用于漂白纸浆、草帽辫等。该氧化物具有还原性,在一定条件下能与常见氧化剂发生反应,写出其中一个反应的化学方程式:_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的原电池装置,下列叙述中正确的是( )
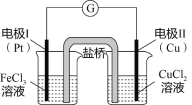
A.电极Ⅰ上发生还原反应,作原电池的负极
B.盐桥中装有含氯化钾的琼脂,其作用是传递电子
C.该原电池的总反应为: Fe3++Cu=Cu2++Fe2+
D.电极Ⅱ的电极反应式为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
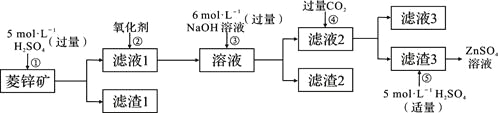
Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)②中使用的氧化剂最好是下列的___(选填字母代号)。
A.Cl2 B.浓HNO3 C.KMnO4 D.H2O2
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤_____(选填①、②、③、⑤)。
(3)写出步骤④后产生滤渣3的化学式______。
(4)与Al相似,Zn也能溶于NaOH溶液。写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式:______________________。
Ⅱ、BaS溶液的制备:
![]()
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
Ba(s)+S(s)=BaS(s) ΔH3=-460 kJ·mol-1
(5)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:______。
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是( )
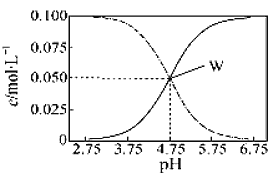
A.pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示的1.0L溶液中通入0.05molHCl气体(忽略溶液体积变化):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)![]() 2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是)
2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是)
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.①④⑧B.②③⑤⑥⑦C.只有①④D.只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.根据表格信息,请回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式_______________________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有____(填写字母序号)。
A.缩小反应容器的容积B.扩大反应容器的容积
C.升高温度D.使用合适的催化剂
E.设法减小平衡体系中的CO浓度
(5)若反应③的逆反应速率与时间的关系如图所示:
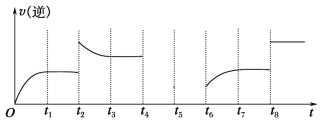
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时________;t8时________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。__________
Ⅱ.25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,

已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)B的分子式为______________,反应①的反应类型为________________
(2)C所含官能团的名称为__________________________________________。
(3)反应⑤的化学方程式为_________________,该反应的反应类型是_________________。
(4)写出满足下列条件的E的同分异构体的结构简式:___________、______________。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备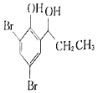 的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OHCH3COOCH2CH3)
CH3CH2OHCH3COOCH2CH3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com