
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
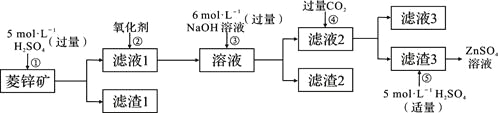
Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)②中使用的氧化剂最好是下列的___(选填字母代号)。
A.Cl2 B.浓HNO3 C.KMnO4 D.H2O2
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤_____(选填①、②、③、⑤)。
(3)写出步骤④后产生滤渣3的化学式______。
(4)与Al相似,Zn也能溶于NaOH溶液。写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式:______________________。
Ⅱ、BaS溶液的制备:
![]()
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
Ba(s)+S(s)=BaS(s) ΔH3=-460 kJ·mol-1
(5)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:______。
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是___。
【答案】D ① Zn(OH)2 Zn-2e-+4OH-=ZnO22-+2H2O BaSO4(s) +4C(s)=BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1 过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率
【解析】
根据菱锌矿的主要成分,加入硫酸后,SiO2与硫酸不反应,故滤渣1主要是SiO2,滤液1中的主要离子有Zn 2+、Fe2+、Cu2+,加入氧化剂,将Fe2+氧化成Fe3+,加入过量的NaOH溶液后Fe3+、Cu2+生成沉淀,由于Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2,所以滤液2的主要成分是Na2ZnO2,通入CO2与Na2ZnO2反应生成的滤渣3是Zn(OH)2,滤液3主要是NaHCO3。
(1)为了不引入新的杂质,氧化剂最好用H2O2,答案选D。
(2)步骤①中加入硫酸与ZnCO3、FeCO3、Cu2(OH)2CO3反应生成的CO2可提供给步骤④使用,故选①。
(3)根据分析滤渣3是Zn(OH)2。
(4)Zn片和Cu片放入NaOH溶液中形成原电池Zn片作负极,与OH-溶液反应生成ZnO22-,负极电极反应式为:Zn-2e-+4OH-=ZnO22-+2H2O。
(5)对题给热化学方程式编号
①Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Ba(s)+S(s)=BaS(s) ΔH3=-460 kJ·mol-1
若煅烧还原的产物仅为BaS和CO,化学方程式为:BaSO4(s) +4C(s)=BaS(s)+4CO(g),根据盖斯定律,将③+②×4-①得,BaSO4(s) +4C(s)=BaS(s)+4CO(g) ΔH=ΔH2×4+ΔH3-ΔH1=(-110.5kJ/mol)×4-460kJ/mol+1473.2kJ/mol=+571.2 kJ·mol-1。
(6)如果生产流程步骤⑤硫酸过量的话,过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率。


科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知![]() ]。下列叙述不正确的是( )
]。下列叙述不正确的是( )

A.NaHA溶液中,HA-的水解能力小于HA-的电离能力
B.lg[K2(H2A)]=-4.2
C.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
D.0.1 mol·L1 NaHA溶液中:c(Na+)+c(A2)+c(H2A)+c(HA)=0.2 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人们在日常生活和工农业生产中应用极为广泛的一种金属。请回答下列问题:
(1)某研究性学习小组为了证明铁的金属性比铜的强,设计了如下几种方案,其中合理的有___(填序号)。
A.铁片置于硫酸铜溶液中置换出铜
B.铁、铜与氯气反应分别生成FeCl3、CuCl2
C.铜片置于FeCl3溶液中,铜片逐渐溶解
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片上无气泡产生
E.常温下,将铁片和铜片分别置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属性比铜的强的实验。要求:该实验方案的原理不同于(1)中任何一个方案。
①画出实验装置图并注明所需药品___。
②写出实验过程中的主要现象:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。

下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 开启啤酒瓶盖,瓶中立即泛起大量泡沫
B. 工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
C. 将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
D. 在pH等于3的醋酸溶液中加入少量CH3COONa,溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是( )
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液为碱性
D.VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应![]() 常用于制作印刷线路板。
常用于制作印刷线路板。
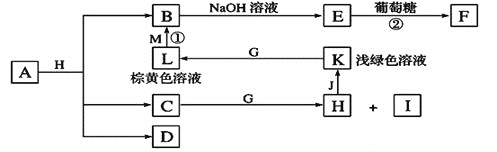
请回答下列问题:
(1)![]() 元素在周期表中的位置______________________,C的电子式______________。
元素在周期表中的位置______________________,C的电子式______________。
(2)比较Y与Z的原子半径大小:___________________![]() 填写元素符号
填写元素符号![]() 。
。
(3)写出实验室制备G的离子反应方程式:_________________________________。
(4)气体D与NaOH溶液反应可生成两种盐P和Q,在P中Na的质量分数为![]() ,其俗名为____________。
,其俗名为____________。
(5)实验室中检验L溶液中的阳离子常选用__________![]() 填化学式
填化学式![]() 溶液,现象是__________________________________________。
溶液,现象是__________________________________________。
(6)![]() 中包含X、Y、Z元素,A的化学式为_________________________________。
中包含X、Y、Z元素,A的化学式为_________________________________。
(7)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其一种同素异形体的名称______________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气用于烟气的脱氮、脱硫的反应:4H2(g)+2NO(g)+SO2(g)![]() N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )
N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )
A.当v(H2)=v(H2O)时,达到平衡
B.升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动
C.使用高效催化剂可提高NO的平衡转化率
D.化学平衡常数表达式为K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用, CO2可用来合成低碳烃。
CO2(g) +4H2(g) ![]() CH4(g) + 2H2O(g) ΔH= a kJ/mol
CH4(g) + 2H2O(g) ΔH= a kJ/mol
(1)已知:①4H2(g)+ 2O2(g)=4H2O(g) △H=-967.2kJ/mol.
②CH4(g) + 2O2(g) =CO2(g) + 2H2O(g) ΔH=-802.0 kJ/mol.
请回答:①②这两个反应在热力学上趋势均很大,其原因是__________________; a=____________kJ/mol。
(2)在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。
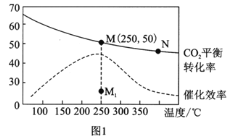
①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=______MPa-2。(Kp是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×体积分数。)
②欲增加二氧化碳的平衡转化率,可采取的措施有__________。
A.通入惰性气体 B.提高温度
C.增加二氧化碳浓度 D.增加氢气浓度
③下列说法正确的是_________。
A.平衡常数大小:KN>KM
B.其他条件不变,若不使用催化剂,则250℃ 时CO2的平衡转化率可能位于点M1
C.图1中M点时,甲烷的体积分数为12.5%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
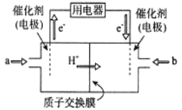
(3)新型高效的甲烷燃料电池工作时总反应式:CH4+2O2=CO2+2H2O。
①该电池的负极是___________(填a或b),②负极电极反应式为___________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com